Từ NaCl; H2O; FeS2 và không khí, chất xúc tác Viết các PTHH điều chế Fe(OH)3 và Fe

Những câu hỏi liên quan
Phương pháp thích hợp điều chế kim loại Na từ NaCl là phương pháp nào trong các phương pháp sau: điện phân dung dịch NaCl, nhiệt phân NaCl, dùng Ca khử Na+ trong dung dịch NaCl, điện phân nóng chảy NaCl.
Điện phân nóng chảy NaCl
\(2NaCl\xrightarrow[]{\text{đ}pnc}2Na+Cl_2\)
Đúng 0
Bình luận (0)
Hãy pha chế 500ml dd NaCl 0,5M từ dd NaCl 2M
Xem chi tiết
\(n_{NaCl}=0,5\times0,5=0,25\left(mol\right)\)
\(\Rightarrow V_{ddNaCl.2M}=\frac{0,25}{2}=0,125\left(l\right)=125\left(ml\right)\)
Đúng 0
Bình luận (1)
Trình bày cách pha 250 g d2 NACL 10% từ d2 NACL 5% và NaCL rắn
| Tính toán | Cách pha chế |
|
Khối lượng NaCl có trong 250g dd NaCl 10%: \(m_{NaCl}=\dfrac{m_{ddNaCl}.C\%_{ddNaCl}}{100\%}=\dfrac{250.10}{100}=25\left(g\right)\) Khối lượng dd NaCl 5% có 25g NaCl: \(m_{ddNaCl}=\dfrac{m_{NaCl}.100\%}{C\%_{ddNaCl}}=\dfrac{25.100}{5}=500\left(g\right)\) |
Đong
|
Đúng 0
Bình luận (0)
Tính lượng chất rắn cần để lấy pha chế dd sau: -) Từ chất rắn KOH tinh khiết pha 500 ml dd KOH 0,1N? Biết E của KOH = 56. -) Từ NaCl tinh khiết pha 250 ml dd NaCl 0.15M? Biết M của NaCl = 58,5
Trình bày cách pha chế 50 ml dung dịch NaCl 0.1M từ dd NaCl 0.2M
\(n_{NaCl}=0,05.0,1=0,005\left(mol\right)\\ V_{ddNaCl\left(bđ\right)}=\dfrac{0,005}{0,2}=0,025\left(l\right)=25\left(ml\right)\\ \Rightarrow V_{nước\left(thêm\right)}=50-25=25\left(ml\right)\)
Hướng dẫn:
- Đong 25ml dung dịch NaCl 0,2M và 25ml nước
- Cho vào ống nghiệm 25ml dd NaCl 0,2M, rồi cho từ từ 25ml nước vào đó.
- Lắc nhẹ => Thu được 50ml dd NaCl 0,1M
Đúng 1
Bình luận (0)
Từ dung dịch NaCl 1M, hãy trình bày cách pha chế 250ml dung dịch NaCl 0,2M.
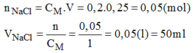
* Cách pha chế:
- Đong lấy 50ml dung dịch NaCl 1M cho vào bình chứa.
- Cho thêm từ từ nước cất vào bình cho đến đủ 250ml, lắc đều, ta được 250ml dung dịch NaCl 0,2M cần pha chế.
Đúng 0
Bình luận (0)
Hãy tính toán và nêu cách pha chế a) 50ml dd CuSO4 0,4 M từ dung dịch CuSO4 2M b) 50g dd NaCl 2,5 % từ dd NaCl 10 %
a) n CuSO4 =0,4.0,05 = 0,02(mol)
=> V dd CuSO4 = 0,02/2 = 0,01(lít) = 10(ml)
=> V H2O thêm vào = 50 - 10 = 40(ml)
Pha chế : Đong lấy 40 ml nước cất cho vào 10 ml dung dịch CuSO4 2M, khuấy đều
b)
m NaCl = 50.2,5% = 1,25(gam)
m dd NaCl 10% = 1,25/10% = 12,5(gam)
=> m H2O cần thêm = 50 - 12,5 = 37,5 gam
- Cân lấy 12,5 gam dd NaCl 10%
- Đong lấy 37,5 gam nước cho vào cốc, khuấy đều.
Đúng 2
Bình luận (0)
Để pha chế 150 gam dung dịch NaCl 2,5% từ dung dịch NaCl 10% thì khối lượng dung dịch NaCl 10% cần dùng là
(1 Point)
37,5 g
50 g
7,5 g
42,5 g
Ta có: \(m_{NaCl}=150\cdot2,5\%=3,75\left(g\right)\) \(\Rightarrow m_{ddNaCl\left(10\%\right)}=\dfrac{3,75}{10\%}=37,5\left(g\right)\)
Đúng 3
Bình luận (0)
Hãy tính toán và nêu cách pha chế 200ml dung dịch NaCl 0,5 M từ dung dịch NaCl 2M
+) Tính toán:
nNaCl = CM.V = 0,1 mol
=> V NaCl2M cần pha = \(\dfrac{n}{CM}=0,05l=50ml\)
+) Pha chế:
- Cho dd muối ăn ( nồng độ 2M ) cho vào cốc thủy tinh có chia vạch dung tích 1000ml
- Rót từ từ Nước cất vào cốc cho tới vạch 200ml thì dừng lại
- Khuấy đều cho Muối ăn tan hết ta thu được 200ml dd NaCl 0,5M
Đúng 0
Bình luận (0)
Từ nước cất và các dụng cụ cần thiết, hãy tính toán và nêu cách pha chế:
a) 100 ml dung dịch MgSO4 0,4M từ dung dịch MgSO4
b) 150 g dung dịch NaCl 2,5% từ dung dịch NaCl 10%.
a) \(m_{MgSO_4}=\dfrac{100}{1000}.0,4=0,04\left(mol\right)
\)
\(m_{MgSO_4}=120.0,04=4,8\left(g\right)
\)
Cân lấy 4,8 g MgSO4 cho vào cốc thủy tinh có dung tích 100ml đổ dần dần nước cất vào cốc và khuấy nhẹ cho đủ 100ml dd . Ta thu được 100ml dd MgSO4
b) \(m_{NaCl}=\dfrac{25}{100}.150=37,5\left(g\right)\)
\(m_{dm}=m_{\text{dd}}-m_{ct}=150-37,5=112,5\left(g\right)\)
Cân lấy 37,5 g NaCl khan cho vào có dung tích 100ml .Cân lấy 112,5 g nước cất rồi đổ dần dần vào cốc và khuấy nhẹ được 150g NaCl 10%
Đúng 2
Bình luận (0)

























