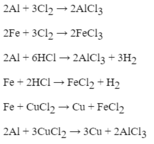So sánh HCl và \(H_2SO_4\) về tính chất hóa học

Những câu hỏi liên quan
So sánh tính chất oxi hóa của các đơn chất F2,Cl2, Br2, I2 và tính khử của những hợp chất HF, HCl, HBr, HI. Dẫn ra những phương trình hóa học để minh họa.
Tính oxi hóa giảm dần từ F2 đến I2.
- Flo là phi kim mạnh nhất, oxi hóa được tất cả các kim loại kể cả vàng và platin. Clo, Br và Iot tác dụng được với một số kim loại.
- Phản ứng với hiđro.

- Halogen đứng trước đẩy halogen đứng sau ra khỏi muối của chúng:
Cl2 + 2NaBr → 2NaCl + Br2
Br2 + 2NaI → 2NaBr + I2
Tính khử của axit tăng theo chiều: HF < HCl < HBr < HI.
- Chỉ có thể oxi hóa F- bằng dòng điện. Còn ion Cl-, Br-, I- đều có thể bị oxi hóa khi tác dụng với chất oxi hóa mạnh.
- HF hoàn toàn không thể hiện tính khử, HCl chỉ thể hiện tính khử khi tác dụng với những chất oxi hóa mạnh, còn HBr và nhất là HI có tính khử mạnh. Axit sunfuric đặc bị HBr khử đến SO2 và bị HI khử đến H2S:
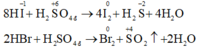
Đúng 1
Bình luận (0)
Phát biểu nào sau đây không đúng về so sánh tính chất hóa học của nhôm và sắt : A. Nhôm và sắt đều bị thụ động trong dung dịch H2SO4 đặc nguội B. Nhôm có tính khử mạnh hơn sắt C. Nhôm và sắt tác dụng với khí Clo dư theo cùng tỉ lệ mol D. Nhôm và sắt đều bền trong không khí ẩm và nước
Đọc tiếp
Phát biểu nào sau đây không đúng về so sánh tính chất hóa học của nhôm và sắt :
A. Nhôm và sắt đều bị thụ động trong dung dịch H2SO4 đặc nguội
B. Nhôm có tính khử mạnh hơn sắt
C. Nhôm và sắt tác dụng với khí Clo dư theo cùng tỉ lệ mol
D. Nhôm và sắt đều bền trong không khí ẩm và nước
Giải thích: Đáp án D
Nhôm bền trong không khí ẩm và nước vì có màng oxit bao bọc
Còn Fe bị oxi hóa thành Fe2O3.nH2O
Đúng 0
Bình luận (0)
So sánh anken với ankan về đặc điểm cấu tạo và tính chất hóa học. Cho thí dụ minh họa.
- Về đặc điểm cấu tạo: Khác với ankan là phân tử chỉ chứa liên kết σ, phân tử anken còn có chứa 1 liên kết π kém bền, dễ gẫy.
- Do đó về tính chất hóa học cũng không giống với ankan là cho phản ứng thế là phản ứng đặc trưng, anken cho phản ứng cộng là phản ứng đặc trưng
Ví dụ:
C2H4 + H2→C2H6 (xúc tác : Ni)
C2H4 + Br2→C2H4Br2
C2H4 + HBr→C2H5Br
Ngoài ra anken còn cho phản ứng trùng hợp phản ứng làm mất màu dung dịch thuốc tím.
Ví dụ :
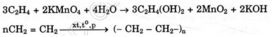
Đúng 0
Bình luận (0)
So sánh HCl và \(H_2SO_4\) loãng về tính chất hóa học
tính chất hóa học của HCl và H2SO4(loãng) thì giống nhau,
+ đổi màu quỳ tím thành đỏ
+tác dụng cới kim loại đứng trc H2 và giải phóng khí H2
+tác dụng với muối của những axit yếu
+tác dụng với oxit axit và oxit bazo
Đúng 0
Bình luận (0)
So sánh những nguyên tố halogen về các mặt sau: Tính chất hóa học.
Tính chất hóa học:
Giống nhau:
- Vì lớp electron lớp ngoài cùng có cấu tạo tương tự nhau (...ns2np5) nên các halogen rất giống nhau về tính chất hóa học của đơn chất cũng như về thành phần và tính chất của các hợp chất.
- Halogen có ái lực với electron lớn. Nguyên tử halogen X với 7 electron lớp ngoài cùng dễ dàng thu thêm 1 electron để trở thành ion âm.
X + 1e → X-
- Oxi hóa được hầu hết các kim loại tạo muối halogennua.
Khác nhau:
- Khả năng oxi hóa của các halogen giảm dần từ flo đến iot.
- Phản ứng với kim loại, với hidro, với nước của các halogen cũng có khác nhau.
- Flo không thể hiện tính khử (không có số oxi hóa dương) còn các halogen khác có tính khử và tính khử tăng dần từ flo đến iot.
Đúng 0
Bình luận (0)
cho 40 gam CuO tác dụng với 200ml \(H_2SO_4\). 1) viết phương trình hóa học. 2) tính số mol của CuO và \(H_2SO_4\). 3) sau phản ứng chất nào dư và dư bao nhiêu gam?
1) CuO + H2SO4→CuSO4 + H2O
2)nCuO = 40/40=1 mol
CuO + H2SO4→CuSO4 + H2O
1 1 mol
nH2SO4=1*1/1=1 mol
Đúng 0
Bình luận (0)
so sánh những nguyên tố halogen về các mặt sau : a) cấu tạo nguyên tử và cấu tạo phân tử ; b) tính chất vật lý ; c) tính chất hóa học .
a) Cấu tạo nguyên tử và cấu tạo phân tử.
- Giống nhau
+ Sô e ngoài cùng có 7 e. Ở trạng thái cơ bản, nguyên tử halogen đều có 1 electron độc thân.
+ Phân tử 2 nguyên tử, liên kết cộng hóa trị không cực.
+ Cấu hình e lớp ngoài cùng ns2 np5
- Khác nhau:
+ Bán kính nguyên tử tăng dần từ flo đến iot.
+ Số lớp e tăng dần từ flo đến iot.
+ Lớp ngoài cùng của nguyên tố flo là lớp thứ 2 nên không cvaó phân lớp d. Nguyên tử clo, brom và iot có phân lớp d còn trống.
+ Ở trạng thái kích thích, nguyên tử clo, brom hoặc iot có thể có 3,5 hoặc 7 e độc thân.
+ Độ âm điện giảm dần từ flo đến iot.
b) Tính chất vật lí
Trong nhóm halogen, tính chất vật lí biến đổi có quy luật:
Trạng thái tập hợp, màu sắc, nhiệt độ nóng chảy, nhiệt độ sôi, …
Từ flo đến iot ta nhận thấy
- Trạng thái tập hợp: từ thể khí chuyển sang thể lỏng và thể khí.
- Màu sắc: đậm dần.
- Nhiệt độ nóng chảy, và nhiệt độ sôi: tăng dần.
- Flo không tan trong nước vì nó phân hủy nước rất mạnh, các halogen khác tan tương đối ít trong nước và tan nhiều trong một số dung môi hữu cơ.
c) Tính chất hóa học.
Giống nhau:
- Vì lớp e lớp ngoài cùng có cấu tao tương tự nhau nên các halogen rất giống nhau về tính chất hóa học của đơn chất cũng như về thành phần và tính chất của các hợp chất.
- Halogen có ái lực với e lớn. Nguyên tử halogen X với 7 e lớp ngoài cùng dễ dàng thu thêm 1 e để trở thành ion âm
X + 1e → X-
- Oxi hóa được hầu hết các kim loại tạo muối halogenua.
Khác nhau:
- Khả năng oxi hóa của các halogen giảm dần từ flo đến iot
- Phản ứng với kim loại , với hidro, với nước của các halogen cũng có khác nhau.
- Flo không thể hiện tính khử không có số oxi hóa dương , còn các halogen khác có tính khử và tính khử tăng dần từ flo đến iot.
chúc chị học tốt ![]()
Đúng 0
Bình luận (0)
kẻ bảng so sánh tính chất vật lý tính chất hóa học ứng dụng và điều chế hidro và oxi
So sánh tính chất hóa học cơ bản của nhôm và sắt.
Viết các phương trình hóa học để minh họa