Hãy nêu định ngĩa phản ứng trao đổi trong dd. Điều kiện để pư trao đổi trong dd xảy ra.Viết pthh minh họa
Câu 1.Hãy nêu định nghĩa của phản ứng trao đổi trong dd và điều kiện để xảy ra pư trao đổi. Viết PT minh họa
Câu 2.Trình bày dãy hoạt động hóa học của kim loại. Viết pthh minh họa
Câu 3.Nêu các giai đoạn sản xuất axit sunfuaric
Mn giúp mik nha...Lm riêng các bài ra nha để mik dễ nhận....Cảm ơn mn trc ạ
Câu 1:
*Phản ứng trao đổi là phản ứng hóa học trong đó các hợp chất tham gia phản ứng trao đổi với nhau thành phần hóa học của chúng để tạo ra những hợp chất mới
Ví dụ: NaCl + AgNO3 -> AgCl + NaNO3
K2CO3 + BaCl2 -> 2KCl + BaCO3
Na2SO3 + 2HCl -> 2NaCl + H2O + SO2
K2CO3 + H2SO4 -> K2SO4 + H2O + CO2
*Điều kiện để pư trao đổi trong dd xảy ra là:
+Sản phẩm pư phải có chất kết tủa(ko tan)
VD. K2CO3 + BaCl2 -> 2KCl + BaCO3
+Sản phẩm pư phải có chất khí bay hơi
VD. K2CO3 + H2SO4 -> K2SO4 + H2O + CO2
+Sản phầm pư phải có chất điện ly yếu như H2O, CH3COOH
VD HCl + NaOH -> NaCl + H2O
Câu 3:
Gồm 3 giai đoạn:
Giai đoạn 1: S + O2 -> SO2
4FeS2 + 11O2 -> 2FeO3 + 8SO2
Giai đoạn 2: 2SO2 + O2 -> 2SO3 (đk: 450oC, xt: V2O5)
Giai đoạn 3: SO3 + H2O -> H2SO4
Trên thực tế người ta ko dùng nc để hấp thụ trực tiếp SO3(vì như vậy nhiệt độ tăng cao, tạo ra H2SO4 dạng sương mù) mà dùng H2SO4 (đặc 98%) để hấp thụ SO3 -> hỗn hợp Oleum
H2SO4 + nSO3 -> H2SO4 . nSO3
Sau đó mới dùng nước hòa tan dần H2SO4 . nSO3 thu dc H2SO4
Câu 2:
K Ba Ca Na Mg Al Zn Fe Ni Sn Pb H Cu Ag Hg Pt Au
- Kim loại đứng trc H đẩy đc H2 ra khỏi dd axit (HCl, H2SO4 loãng,...)
VD. Zn + 2HCl -> ZnCl2 + H2↑
2Al + 3H2SO4 -> Al2(SO4)3 + 3H2↑
- Riêng K, Ba,Ca,Na còn đẩy đc H2 ra khỏi nước.
VD. 2Na + 2H2O -> 2NaOH + H2↑
Ba + 2H2O -> Ba(OH)2 + H2↑
-Từ Mg trở đi, kim loại đứng trc đẩy dc kim loại đứng sau ra khỏi dd muối của chúng
VD. Cu + 2AgNO3 -> Cu(NO3)2 + 2Ag↓
Fe + CuSO4 -> FeSO4 + Cu↓
(Khi pư vs các dd axit HCl, dd H2SO4 loãng và các dd muối của kim loại đứng sau, Fe chỉ có hóa trị II)
Thế nào là phản ứng trao đổi trong dung dịch? Cho ví dụ? Điều kiện để xảy ra phản ứng tra đổi trong dung dịch là gì?
Phản ứng trao đổi là một loại phản ứng hoá học, trong đó, các chất trao đổi cho nhau thành phần cấu tạo của nó mà không làm thay đổi chỉ số oxi hóa. Từ sự trao đổi này, chúng hình thành nên những chất mới của phương trình phản ứng
* Ví dụ:
HCl + NaOH → NaCl + H2O
H2SO4 + 2KOH → K2SO4 + 2H2O
* Điều kiện:
- Các chất tạo thành phải có ít nhất một chất kết tủa hoặc dễ bay hơi hay dễ phân huỷ, hoặc yếu hơn so với chất tham gia (đối với axít)
- Muối và bazơ (ban đầu) phải tan.
Một trong 2 sản phẩm có kết tủa
- Hai muối tham gia phản ứng đều tan.
- Sản phẩm có chất kết tủa hoặc có chất khí bay hơi
Điều kiện để xảy ra phản ứng trao đổi ion trong dung dịch chất điện li là gì? Lấy các ví dụ minh hoạ?
- Sau phản ứng tạo thành chất kết tủa
Na2CO3 + CaCl2 → 2NaCl + CaCO3 ↓
2Na+ + CO3- + Ca2+ + 2Cl- → 2Na+ + 2Cl- + CaCO3 ↓
Ca2+ + CO3- → CaCO3 ↓
- Sau phản ứng tạo thành chất dễ bay hơi
Na2S + 2HCl → 2NaCl + H2S ↑
2Na+ + S2- + 2H+ + 2Cl- → 2Na+ + 2Cl- + H2S ↑
2H+ + S2- → H2S ↑
- Sau phản ứng tạo thành chất điện li yếu
2CH3COONa +H2SO4 → 2CH3COOH + Na2SO4
2CH3COO- + 2Na+ + 2H+ + SO42- → 2CH3COOH +2Na+ + SO42-
CH3COO- + H+ → CH3COOH
hãy nêu điều kiện để phản ứng trao đổi trong dung dịch các chất xảy ra
Chia ra các trường hợp:
- Phản ứng giữa axit và muối : Thỏa mãn một trong 2 điều kiện phản ứng sau:
+)Axit mới yếu hơn hoặc dễ bay hơi hơn axit ban đầu.
+)Muối mới kết tủa hoạc axit mới yếu hơn hoặc dễ bay hơi hơn axit ban đầu.
- Phản ứng giữa bazơ và muối: Thỏa mãn cả hai điều kiện sau
+) Muối và bazơ (ban đầu) phải tan.
+)Một trong 2 sản phẩm có kết tủa.
- Phản ứng giữa muối và muối: Thỏa mãn cả hai Điều kiện sau:
+)Hai muối tham gia phản ứng đều tan.
+)Sản phẩm có chất kết tủa hoặc có chất khí bay hơi.
-axit +muối( axit tan , muối có thể không tan) tạo thành muối kết tủa hoặc chất bay hơi hoặc chỉ cần axít
- bazơ +muối( bazơ kiềm , muối tan ) tạo thành bazơ không tan hoặc muối không tan
- muối + muối( 2 muối tan ) tạo thành chất kết tủa
- axit và bazơ luôn phản ứng![]()
![]()
Điều kiện xảy ra phản ứng trao đổi :
+ Trong phản ứng chỉ tạo ra chất khí hoặc chất không tan
+ Axit mới yếu hơn hoặc dễ bay hơi hơn axit ban đầu.
Muối mới kết tủa hoạc axit mới yếu hơn hoặc dễ bay hơi hơn axit ban đầu.
2. Axit (mới) phải yếu hơn axit cũ dù muối mới kết tủa
Cho 50g dd FeCl3 32,5% tác dụng với 125g dd KOH 17,92%.
a) Viết PTHH? Phân loại phản ứng và nêu điều kiện để phản ứng này xảy ra
b) Tính nồng độ phần trăm các chất trong dd sau phản ứng
pthh
FeCl3+3KOH--->Fe(OH)3+3KCl
đây là phản ứng trao đổi
dk: sp tạo thành có ít nhất 1 kêt tua hoặc chất khí
trong bài này Fe(OH)3 là kết tủa nó có màu đỏ nâu
Có thể điều chế MgCl2 bằng các pư sau, hãy viết pthh và cho biết pư nào là pứ oxi hóa khử? Giải thích
- Phản ứng hóa hợp
- Phản ứng thế
- Phản ứng trao đổi
a, Pứ hóa hợp
\(\text{Mg + Cl2 ---> MgCl2}\)
Pứ oxh - khử. vì có sự thay đổi số oxhi hóa, Mg từ số oxh 0 lên +2; Clo từ 0 xuống -1
b, Pứ thế
\(\text{Mg +2 HCl ---> MgCl2 + H2}\)
--> Pứ oxh - khử.vì có sự thay đổi số oxhi hóa, Mg từ số oxh 0 lên +2, H từ +1 xuống 0
c, Pứ trao đổi
\(\text{MgSO4 + BaCl2 ---> MgCl2 + BaSO4 }\)
-> Ko là pứ oxh - k. vì k có sự thay đổi số oxh
Phản ứng nào dưới đây là phản ứng trao đổi ion trong dd ?
A. Zn + 2HCl → ZnCl2 + H3.
B. FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl.
C. 2FeCl2 + Cl2 → 2FeCl3 .
D. MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O.
Phản ứng nào dưới đây là phản ứng trao đổi ion trong dd ?
A. Zn + 2HCl → ZnCl2 + H3.
B. FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl.
C. 2FeCl2 + Cl2 → 2FeCl3 .
D. MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O.
Phản ứng nào trong số các phản ứng dưới đây là phản ứng trao đổi ion trong dung dịch có thể dùng để điều chế HF?
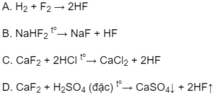
Đáp án: D.
Phản ứng C cũng là phản ứng trao đổi ion và tạo ra HF, nhưng khi đun nóng cả HCl bay ra cùng với HF, nên không dùng để điều chế HF được.
Tìn những phát biểu đúng
1. Tất cả các muối nitrat đều tan trong nước và là chất điện li mạnh
2. Tất cả các muối nitrat có thể tham gia pư trao đổi ion vs dd NaOH
3. KNO3 được sử dụng để chế thuốc nổ đen
4. Dd muối nitrat thể hiện tính oxi hóa trong môi trường axit
5. Muối nitrat rắn rất bền vs nhiệt
6. HNO3 loãng không thể hiện tính oxi hóa khi tác dụng vs Fe2O3
7. Axit nitric có tính oxi hóa rất mạnh
8. Pư giữa HNO3 vs FeO tạo ra khí NO. Số phân tử HNO3 bị FeO khử là 10