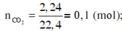Đốt chấy hoàn toàn 7,3g hợp chất hữu cơ A thu đc 13,2g CO2 và 4,5g H2O. Mặt khác khi hóa hơi hoàn toàn 29,2g hợp chất hữu cơ thu đc thể tích hơi bằng thể tích của 6,4g O2 ( đktc ). Xác định hợp chất hữu cơ trên

Những câu hỏi liên quan
Đốt cháy hoàn toàn 5,8 gam hợp chất hữu cơ A , sau phản ứng chỉ thu đc 6,72 lít Co2 (đktc) và 5,4g H2O . Mặt khác đem hóa hơi 2,32 g hợp chất A thì thể tích thu đc bằng 1/3 thể tích của 1,92 g khí O2 đo ở cùng điều kiện . (a) hãy lập ct phân tử của A (. b) B là một đồng phân của A biết rằng B có cấu tạo mạch hở Và B tác dụng được với KOH , CACO3 .Hãy viết công thức cấu tạo của B
Xem chi tiết
nCO2 = \(\dfrac{6,72}{22,4}\)= 0,3 mol , nH2O = \(\dfrac{5,4}{18}\)= 0,3 mol
=> mC = 0,3.12 = 3,6 gam , mH = 2nH2O . 1 = 0,6gam
mC + mH = 4,2g < mA => Trong A ngoài C và H còn có Oxi
mO = 5,8 - 4,2 = 1,6 gam <=> nO = 1,6/16 = 0,1 mol
Gọi CTĐGN của A là CxHyOz
Ta có x:y:z = nC:nH:nO = 3:6:1 => CTPT của A là (C3H6O)n
2,32 g A có thể tích = 1/3 thể tích 1,92 gam O2 ở cùng điều kiện
=> 2,32 g A có số mol = 1/3 số mol của 1,92 gam O2 = \(\dfrac{1,92}{32.3}\)= 0,02mol
<=> MA = \(\dfrac{2,32}{0,02}\)= 116(g/mol)
=> n = 2 và CTPT của A là C6H12O2
b) B tác dụng được với KOH, CaCO3 => B là axit cacboxylic
CH3-(CH2)4-COOH
Đúng 2
Bình luận (0)
Anh chị làm ơn giúp e mấy bài này ạ.E cảm ơn!Bài 1:Khi đốt cháy hoàn toàn một lượng hợp chất hữu cơ X cần 0,8 gam O2 người ta thu được 1,1 gam CO2,0,45 gam H2O và không có sản phẩm nào khác. Xác định công thức phân tử của X. Biết rằng khi cho bay hơi hoàn toàn 0,6gam X ở điều kiện nhiệt độ và áp suất thích hợp đã thu được một thể tích hơi đúng bằng thể tích hơi của 0,32 gam O2 trong cùng điều kiện.Bài 2:Đốt cháy hoàn toàn một hợp chất hữu cơ A có thành phần C,H,O thu được CO2 có thể tích bằng 3/...
Đọc tiếp
Anh chị làm ơn giúp e mấy bài này ạ.E cảm ơn!
Bài 1:
Khi đốt cháy hoàn toàn một lượng hợp chất hữu cơ X cần 0,8 gam O2 người ta thu được 1,1 gam CO2,0,45 gam H2O và không có sản phẩm nào khác. Xác định công thức phân tử của X. Biết rằng khi cho bay hơi hoàn toàn 0,6gam X ở điều kiện nhiệt độ và áp suất thích hợp đã thu được một thể tích hơi đúng bằng thể tích hơi của 0,32 gam O2 trong cùng điều kiện.
Bài 2:
Đốt cháy hoàn toàn một hợp chất hữu cơ A có thành phần C,H,O thu được CO2 có thể tích bằng 3/4 thể tích hơi nước và bằng 6/7 thể tích O2 dùng để đốt cháy. Mặt khác, 1l hơi A có khối lượng bằng 46 lần khối lượng 1 lít H2 ở cùng điều kiện.Tìm công thức phân tử của A.
Bài 3: Đốt cháy hoàn toàn 4,3 gam hợp chất hữu cơ thu được 6,72 lít CO2 và 0,35 mol H2O. Khi đốt cháy hoàn toàn 1 mol chất A cần 212,8l O2.Xác định CTPT của A.
Khi đốt cháy hoàn toàn 5,9 gam hợp chất hữu cơ A thu được 6,72 lít khí CO2(đkc); 1,12 lít khí N2 và 8,1g H2O. Mặt khác, khi hoá hơi 2,9 gam hợp chất hữu cơ A chiếm thể tích đúng bằng thể tích của 1,6g O2 ở cùng điều kiện. Tìm công thức phân tử hợp chất hữu cơ A.
Đốt cháy hoàn toàn 7,4 gam hợp chất hữu cơ X ( C, H, O ). Thu được 6,72 lít
CO
2
(đktc) và 5,4 gam
H
2
O
. Khi hóa hơi 1,85 gam X, thu được thể tích bằng với thể tích của 0,7 gam
N
2
cùng nhiệt độ, áp suất. Xác định công thức phân tử của X A.
C
5
H
10...
Đọc tiếp
Đốt cháy hoàn toàn 7,4 gam hợp chất hữu cơ X ( C, H, O ). Thu được 6,72 lít CO 2 (đktc) và 5,4 gam H 2 O . Khi hóa hơi 1,85 gam X, thu được thể tích bằng với thể tích của 0,7 gam N 2 cùng nhiệt độ, áp suất. Xác định công thức phân tử của X
A. C 5 H 10 O
B. C 3 H 6 O 2
C. C 2 H 2 O 3
D. C 3 H 6 O
Đáp án B
Đặt CTPT của X là CxHyOz
Do ở cùng điều kiện nhiệt độ và áp suất thì tỉ lệ về thể tích cũng chính là tỉ lệ về số mol.
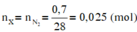
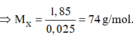

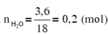
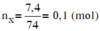
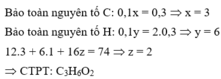
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 7,2g hợp chất hữu cơ A thu đc 10,56g CO2 và 4,32g H2O
a. Xác định CTPT của hợp chất A biết 1 lít hơi A(đktc) nặng 2,679g
b.Biết A là axit hữu cơ.Xác định CTCT đúng của A
\(a,M_A=22,4.2,679=60\left(g\text{/}mol\right)\\ n_C=n_{CO_2}=\dfrac{10,56}{44}=0,24\left(mol\right)\\ n_H=2n_{H_2O}=2.\dfrac{4,32}{18}=0,48\left(mol\right)\\ n_O=\dfrac{7,2-0,24.12-0,48}{16}=0,24\left(mol\right)\)
CTPT của A có dạng: \(C_xH_yO_z\left(x,y,z\in N\text{*}\right)\)
\(\rightarrow x:y:z=0,24:0,48:0,24=1:2:1\\ \rightarrow CTĐGN:\left(CH_2O\right)_n\left(n\in N\text{*}\right)\\ \rightarrow30n=60\\ \rightarrow n=2\left(TM\right)\)
\(CTPT:C_2H_4O_2\)
b, A là axit hữu cớ
\(\rightarrow CTCT:CH_3-COOH\)
Đúng 5
Bình luận (0)
1. Đốt cháy hoàn toàn 8,9g một hợp chất hữu cơ X bằng khí oxi , vừa đủ. Sau pư thu đc 13,2g CO2 , 6,3g H2O và 1,12 lít khí N2(đktc). Công thức đơn giản nhất của X là?
2. Đốt cháy hoàn toàn 9,2g một hợp chất hữu cơ X bằng 13,44 lít khí oxi( đktc) vừa đủ. Sau pư thu đc m1 gam CO2 và m2 gam H2O. Biết m1:m2 = 44:27 . Công thức đơn giản nhất của X là?
Xem chi tiết
nC = nCO2 = 0,3
nH = 2nH2O = 0,7
nN = 2nN2 = 0,1
=> nO = (mA – mC – mH – mN)/16 = 0,2
=>; C : H : N : O = 3 : 7 : 1 : 2
nA = nO2 = 0,05
=>MA = 89
=>A là C3H7NO2
Đúng 2
Bình luận (0)
Bài 1
\(n_{CO_2}=\dfrac{13.2}{44}=0.3\left(mol\right)\Rightarrow n_C=0.3\left(mol\right)\Rightarrow m_C=3.6\left(g\right)\)
\(n_{H_2O}=\dfrac{6.3}{18}=0.35\left(mol\right)\Rightarrow n_H=0.7\left(mol\right)\)
\(n_{N_2}=\dfrac{1.12}{22.4}=0.05\left(mol\right)\Rightarrow n_N=0.1\left(mol\right)\Rightarrow m_N=0.1\cdot14=1.4\left(g\right)\)
\(m_O=8.9-3.6-0.7-1.4=3.2\left(g\right)\)
\(n_O=\dfrac{3.2}{16}=0.2\left(mol\right)\)
\(Gọi:CTHH:C_xH_yO_zN_t\)
\(x:y:z:t=0.3:0.7:0.2:0.1=3:7:2:1\)
\(CTđơngarin\::C_3H_7O_2N\)
Đúng 2
Bình luận (0)
Đốt cháy hoàn toàn 6 gam hợp chất hữu cơ A chỉ thu được 8,8 g CO2 và 3,6 g nước. Xác điinhj CTPT của A biết khi Hóa hơi 3 gam A thu được thể tích bằng thể tích của 1,6 gam O2 ( cùng điều kiện nhiệt độ, áp suất) Giải theo 3 cách! Mọi người giúp mình gấp với ạ ^^
Ta có \(n_{CO_2}=\dfrac{8,8}{44}=0,2(mol);n_{H_2O}=\dfrac{3,6}{18}=0,2(mol)\)
Bảo toàn C và H: \(n_{C}=0,2(mol);n_{H}=0,4(mol)\)
\(\Rightarrow m_A=m_C+m_H=0,2.12+0,4.1=2,8<6\)
Do đó A chứa O
\(\Rightarrow m_O=6-2,8=3,2(g)\\ \Rightarrow n_O=\dfrac{3,2}{16}=0,2(mol)\)
Đặt \(CTHH_A:C_xH_yO_z\)
\(\Rightarrow x:y:z=0,2:0,4:0,2=1:2:1\\ \Rightarrow CTPT_A:CH_2O\)
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn 3 gam hợp chất hữu cơ X, thu được 2,24 lít
CO
2
(đktc) và 1,8 gam
H
2
O
. Hóa hơi 2,25 gam X thu được thể tích bằng với thể tích của 0,4 gam oxi đo cùng nhiệt độ, áp suất. Công thức phân tử của X là A.
C
9
H
8
O
4
...
Đọc tiếp
Đốt cháy hoàn toàn 3 gam hợp chất hữu cơ X, thu được 2,24 lít CO 2 (đktc) và 1,8 gam H 2 O . Hóa hơi 2,25 gam X thu được thể tích bằng với thể tích của 0,4 gam oxi đo cùng nhiệt độ, áp suất. Công thức phân tử của X là
A. C 9 H 8 O 4
B. C 2 H 2 O 2
C. C 6 H 12 O 6
D. C 3 H 6 O 3
đốt cháy hoàn toàn 6,9g một chất hữu cơ A thu đc 13,2g khí CO2 và 8,1g H2O. Biết tỉ khối hơi của A so với H2 là 23
a, Xác định công thức phân tử của A
b, Viết công thức cấu tạo của A biết A tác dụng đc với natri giải phóng khí H2. Tính thể tích khí H2 thoát ra (đktc)
a)
n C = n CO2 = 13,2/44 = 0,3(mol)
n H2O = 8,1/18 = 0,45(mol) => n H = 2n H2O = 0,9(mol)
=> n O = (6,9 - 0,3.12 - 0,9.1)/16 = 0,15(mol)
Ta có :
n C : n H : n O = 0,3 : 0,9 : 0,15 = 2 : 6 : 1
Vậy CTP của A là (C2H6O)n
M A = (12.2 + 6 + 6)n = 23.2
=> n = 1
Vậy CTPT của A : C2H6O
b)
CTCT : CH3-CH2-OH
n A = 1/2 n CO2 = 0,15(mol)
$2CH_3-CH_2-OH + 2Na \to 2CH_3-CH_2-ONa + H_2$
n H2 = 1/2 n A = 0,075 mol
=> V H2 = 0,075.22,4 = 1,68 lít
Đúng 2
Bình luận (0)