Đốt cháy hoàn toàn 3,1 g P trong O2 dư. Cho toàn bộ sản phẩm tạo thành tác dụng với H2O thì thu được 500ml dd
a. Viết PTHH của các phản ứng hóa học
b. Tính nồng độ mol của dd tạo thành
cho 1 lượng kim loại Mg tác dụng hoàn toàn với 500ml dd H2SO4 nồng độ 2M
a) viết PTHH của phản ứng . tính thể tích khí thu được sau phản ứng ở đktc
b) tính nồng độ mol của dd muối tạo thành , coi thể tích dd thay đổi không đáng kể
Đốt cháy hoàn toàn 3,1 gam Photpho dư. Cho toàn bộ sản phẩm tạo thành tác dụng với H2O tạo thành 500 ml dung dịch
a) Viết phương trình
b) Tính CM của dung dịch tạo thành
Ghi tóm tắt, lời giải chi tiết rõ ràng
a) Phương trình phản ứng khi đốt cháy hoàn toàn 3,1 gam Photpho dư và cho sản phẩm tác dụng với H2O:
P4 + 502 → 2P205
P205 + 3H2O → 2H3PO4
b) Tính nồng độ mol của dung dịch tạo thành:
Đầu tiên, ta cần tính số mol của P4:
M(P4) = 31 x 4 = 124 g/mol n(P4) = m/M= 3,1/124 = 0,025 mol
+ Theo phương trình phản ứng, mỗi mol P4 sẽ tạo ra 2 mol H3PO4. Vậy số mol H3PO4 tạo thành là: n(H3PO4) = 2 x n(P4) = 0,05 mol
- Dung dịch có thể coi là pha rắn, о do đó khối lượng của dung dịch là khối lượng của H3PO4 tạo thành. Ta biết:
m(H3PO4) = n(H3PO4) x M(H3PO4) = 0,05 x 98 = 4,9 g
0 Thể tích dung dịch là 500 ml = 0,5 L. Vậy nồng độ mol của dung dịch là:
C = n(H3PO4)/V = 0,05/0,5 = 0,1 mol/L
Vậy nồng độ mol của dung dịch tạo thành là 0,1 mol/L.
Tóm tắt:
+ Số mol P4 = 0,025 mol
+ Số mol H3PO4 tạo thành = 0,05 mol
+ Khối lượng H3PO4 tạo thành = 4,9 g
Thể tích dung dịch = 500 ml = 0,5 L
+ Nồng độ mol của dung dịch tạo thành = 0,1 mol/L.
Đốt cháy hoàn toàn 3,1 gam Photpho dư. Cho toàn bộ sản phẩm tạo thành tác dụng với H2O tạo thành 500 ml dung dịch
a) Viết phương trình
b) Tính CM của dung dịch tạo thành
Ghi tóm tắt, lời giải chi tiết rõ ràng
a) Phương trình phản ứng giữa Photpho và O2:
P4 + 502 → 2P205
Phương trình phản ứng giữa P2O5 và H2O:
P205 + 3H2O → 2H3PO4
Tổng phương trình phản ứng:
P4+502 + 6H20 → 4H3PO4
b) Để tính nồng độ mol của dung dịch, ta cần biết số mol của H3PO4 trong dung dịch và thể tích của dung dich.
Số mol H3PO4 = số mol P4 đã phản ứng hết với O2
Theo phương trình phản ứng, ta có: 1 mol P4 tạo thành 4 mol H3PO4
Nồng độ mol của H3PO4 trong dung dich:
n(H3PO4) = (3,1 g P4 / 123,9 g/mol) x (4 mol H3PO4 / 1 mol P4) = 0,099 mol
Thể tích dung dịch là 500 ml = 0,5 L
Cô đặc dung dịch từ 500 ml xuống 250 ml, nồng độ mol của dung dịch sẽ tăng gấp đôi:
C(H3PO4)= n(H3PO4) / V(dung dịch) = 0,099 mol / 0,25 L = 0,396 M
Vậy, nồng độ mol của dung dịch là 0,396 M.
đốt cháy hoàn toàn 6,2 gam photpho trong oxi dư . cho sản phẩm tạo thành tác dụng vừa đủ với dung dịch NaOH 32% tạo ra muối Na2HPO4 .
a) viết phương trình hóa học của các phản ứng xảy ra .
b) tính khối lượng dung dịch NaOH đã dùng .
c) tính nồng độ phần trăm của muối trong dung dịch thu được sau phản ứng .
a, (1) 4P+5.O2->2.P2O5
(2) P2O5+4.NaOH->2.Na2HPO4+H2O
b, photpho có n=6,2:31=0,2 mol.dựa theo pt (1) thấy nP2O5=0,1mol.theo pt (2) thấy nNaOH=0,4mol vậy mNaOH=0,4.40=16 g vậy m(dd NaOH)=16:32%=50 g
c, theo pt (2) nNa2HPO4 =0,2 mol vậy mNa2HPO4=0,2.142=28,4 g
m(dd sau pư)=mP+m(dd NaOH)=6,2+50=56,2 g
=> C%(dd Na2HPO4)=28,4:56,2=50,53%
đốt cháy hoàn toàn 6,2 gam photpho trong oxi dư . cho sản phẩm tạo thành tác dụng vừa đủ với dung dịch NaOH 32% tạo ra muối Na2HPO4 .
a) viết phương trình hóa học của các phản ứng xảy ra .
b) tính khối lượng dung dịch NaOH đã dùng .
c) tính nồng độ phần trăm của muối trong dung dịch thu được sau phản ứng .
Đốt cháy hoàn toàn 6,2 gam photpho trong oxi dư. Cho sản phẩm tạo thành tác dụng vừa đủ với dung dịch NaOH 32% tạo ra muối Na2HPO4. Tính nồng độ phần trăm của muối trong dung dịch thu được sau phản ứng?
Theo pt: nNa2HPO4 = 2.nP2O5 = 0,1. 2 = 0,2 mol
Theo định luật bảo toàn khối lượng:
Khối lượng dung dịch sau phản ứng = khối lượng các chất tham gia phản ứng = mNaOH + mP2O5 = 50 + 0,1.142 = 64,2
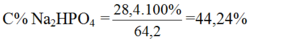
Đốt cháy m(g) hỗn hợp gồm metan , etilen . dẫn toàn bộ sản phẩm cháy và dd nước vôi trong dư thu được 50g kết tủa trắng . cùng hh trên khi dẫn vào dd br dư thì m Br phản ứng là 8g . A. viết pthh B)tính m và thành phần trăm theo khối lượng của mỗi chất ban đầu
a)
\(CH_4 + 2O_2 \xrightarrow{t^o} CO_2 + 2H_2O\\ C_2H_4 + 3O_2 \xrightarrow{t^o} 2CO_2 + 2H_2O\\ CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O\\ C_2H_4 + Br_2 \to C_2H_4Br_2\\ b) n_{C_2H_4} = n_{Br_2} = \dfrac{8}{160}=0,05(mol)\\ n_{CaCO_3} = n_{CO_2} = n_{CH_4} + 2n_{C_2H_4} = \dfrac{50}{100} = 0,5(mol)\\ \Rightarrow n_{CH_4} = 0,5 - 0,05.2 = 0,4(mol)\\ \%m_{CH_4}= \dfrac{0,4.16}{0,4.16 + 0,05.28}.100\% = 82,05\%\\ \%m_{C_2H_4} =100\% - 82,05\% = 17,95\%\)
Bài tập 3: Hòa tan hoàn toàn 38,25 gam BaO vào HạO thu được 500ml dd X. a) Tính nồng độ mol của dung dịch X. b)Cho dd X tác dụng hết với dd H,SO, dư tính khối lượng kết tủa tạo thành. Giải: dói 500ml 0,5 lit
Đốt cháy hoàn toàn 15,5g photpho trong oxi dư
a) viết pthh xảy ra
b) Tính kl điphotpho pentaoxit thu đc
c) hòa tan toàn bộ lượng diphotpho pentaoxit thu đc ở trên tạo thành 100g dd. Tính nồng đồ % của dd tạo thành.
a) 4P + 5O2 --to--> 2P2O5
b) \(n_P=\dfrac{15,5}{31}=0,5\left(mol\right)\)
PTHH: 4P + 5O2 --to--> 2P2O5
0,5--------------->0,25
=> mP2O5 = 0,25.142 = 35,5 (g)
c)
PTHH: P2O5 + 3H2O --> 2H3PO4
0,25------------>0,5
=> \(C\%=\dfrac{0,5.98}{100}.100\%=49\%\)
4P+5O2-to>2P2O5
0,5-------------0,25
n P=0,5 mol
=>m P2O5=0,25.142=35,5g
c)P2O5+3H2O->2H3PO4
0,25---------------------0,5
=>C%=\(\dfrac{0,5.98}{100}100=49g\)