Cho 7,8g hỗn hợp kim loại M (M hoá trị II) và Al tác dụng với H2SO4 loãng dư thì thu được 8,96 lit khí (đktc)
a/ Tính khối lượng muối thu được
b/ Xác định M biết trong hỗn hợp đầu tỉ lệ số mol M:Al=1:2
Cho một lượng hỗn hợp Al, Fe tác dụng với dung dịch H 2 S O 4 loãng, dư thấy thu được 8,96 lít khí ở đktc. Mặt khác, cho lượng hỗn hợp như trên tác dụng với dung dịch NaOH dư thì thu được 6,72 lít khí H 2 ở đktc. Tính % khối lượng mỗi kim loại trong hỗn hợp ban đầu.
Cho 7,8 gam hỗn hợp hai kim loại Mg và Al tác dụng với dung dịch H2SO4 loãng dư. Khi phản ứng kết thúc người ta thu được 8,96 lít khí (đktc).
a. Viết các phương trình hoá học xảy ra
b. Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu.
c. Tính thể tích dung dịch H2SO4 2 M đã tham gia phản ứng
a)
2Al + 3H2SO4 → Al2(SO4)3 +3H2
Mg + H2SO4 → MgSO4 + H2
b. n H2 = 8,96/22,4 =0,4 mol
Gọi x và y là số mol của Al và Mg ta có hệ
27x+ 24y = 7,8 (1)
1,5x+ y = 0,4 (2)
Từ 1 và 2 => x = 0,2 ; y = 0,1
Khối lượng của Al và Mg là:
mAg = 0,2.27=5,4(gam)
mMg = 7,8 – 5,4 = 2,4(gam)
c. Theo phương trình số mol của H2SO4 là : 0,3 + 0,1 = 0,4(mol)
Thể tích dung dịch H2SO4 2M đã tham gia phản ứng là:
V = 0,4/2=0,2 lít
Gọi nMg = a (mol); nAl = b (mol)
=> 24a + 27b = 7,8 (1)
nH2 = 8,96/22,4 = 0,4 (mol)
PTHH:
Mg + H2SO4 -> MgSO4 + H2
a ---> a ---> a ---> a
2Al + 3H2SO4 -> 2Al2(SO4)3 + 3H2
b ---> 1,5b ---> b ---> 1,5b
=> a + 1,5b = 0,4 (2)
(1)(2) => a = 0,1 (mol); b = 0,2 (mol)
mMg = 0,1 . 24 = 2,4 (g)
mAl = 0,2 . 27 = 5,4 (g)
nH2SO4 = 0,1 + 0,3 . 1,5 = 0,4 (mol)
VddH2SO4 = 0,3/2 = 0,2 (l)
a.b.\(n_{H_2}=\dfrac{8,96}{22,4}=0,4mol\)
Gọi \(\left\{{}\begin{matrix}n_{Mg}=x\\n_{Al}=y\end{matrix}\right.\)
\(Mg+H_2SO_4\left(l\right)\rightarrow MgSO_4+H_2\)
x x ( mol )
\(2Al+3H_2SO_4\left(l\right)\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
y 3/2y ( mol )
Ta có:
\(\left\{{}\begin{matrix}24x+27y=7,8\\x+\dfrac{3}{2}y=0,4\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\)
\(\Rightarrow m_{Mg}=0,1.24=2,4g\)
\(\Rightarrow m_{Al}=0,2.27=5,4g\)
c.\(Mg+H_2SO_4\left(l\right)\rightarrow MgSO_4+H_2\)
0,1 0,1 ( mol )
\(2Al+3H_2SO_4\left(l\right)\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,2 0,3 ( mol )
\(V=\dfrac{n}{C_{M\left(H_2SO_4\right)}}=\dfrac{0,1+0,3}{2}=0,2l\)
Hỗn hợp A chứa Fe và kim loại M có hóa trị không đổi trong mọi hợp chất. Tỉ lệ số mol của M và Fe trong hỗn hợp là 1 : 3. Cho 19,2 gam hỗn hợp A tan hết vào dung dịch HCl thu được 8,96 lít khí H2 Cho 19,2 gam hỗn hợp A tác dụng hết với Cl2 thì cần dùng 13,32 lít khí Cl2. Xác định kim loại M và phần trăm khối lượng các kim loại trong hỗn hợp A. Các thể tích khí đo ở đktc.
Gọi hóa trị của M là n
Gọi nMg = x mol ⇒ nFe = 3.x mol
Số mol H2 là: nH2 = 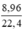 = 0,4 (mol)
= 0,4 (mol)
Số mol Cl2 là: nCl2 = 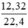 = 0,55 (mol)
= 0,55 (mol)
Các PTHH
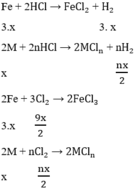
Theo bài ra ta có hệ phương trình:
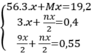
Giải hệ pt ⇒ x = 0,1 mol ⇒ n = 2 ⇒ M = 24
Vậy M là Mg
nMg = 0,1 mol ⇒ nFe = 0,3 mol
Thành phần % theo khối lượng
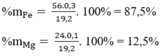
Cho 7,8 gam hỗn hợp hai kim loại là Mg và Al tác dụng với dung dịch H 2 SO 4 loãng, dư. Khi phản ứng kết thúc, người ta thu được 8,96 lít khí (đktc). Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu.
Khối lượng kim loại trong hỗn hợp:
- Số mol H 2 ở (1) và (2) n H 2 = 8,96/22,4 = 0,4 mol
- Đặt x và y là số mol Mg và Al có trong hỗn hợp. Từ (1) và (2) ta có hệ phương trình đại số :
x + 3/2y = 0,4
24x + 27y = 7,8
Giải hệ phương trình, ta được x = 0,1 và y = 0,2.
Khối lượng các kim loại :
m Mg = 0,1 x 24 = 2,4g
m Al = 0,2 x 27 = 5,4g
cho 11g một hỗn hợp gồm Fe và Al tác dụng vừa đủ với 200ml dung dịch axit H2SO4 2(M), thì thu được V lit khí H2 (dktc)
a) xác định thành phần % về khối lượng của mỗi kim loại trong hỗn hợp đầu
b) tìm V
c) tính nồng độ các muối trong dung dịch sau phản ứng
\(n_{H_2SO_4}=0,2.2=0,4\left(mol\right)\)
Fe + H2SO4 → FeSO4 + H2
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Gọi x,y lần lượt là số mol Fe, Al
\(\left\{{}\begin{matrix}56x+27y=11\\x+\dfrac{3}{2}y=0,4\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\)
=>\(\%m_{Fe}=\dfrac{0,1.56}{11}.100=50,91\%\)
=> %m Al = 100 - 50,91 =49,09 %
b)Theo PT: \(n_{H_2}=n_{H_2SO_4}=0,4\left(mol\right)\)
=> \(V_{H_2}=0,4.22,4=8,96\left(l\right)\)
c) \(CM_{FeSO_4}=\dfrac{0,1}{0,2}=0,5M\)
\(CM_{Al_2\left(SO_4\right)_3}=\dfrac{\dfrac{0,2}{2}}{0,2}=0,5M\)
Cho m gam hỗn hợp gồm Al, Cu tác dụng với dd H2SO4 loãng dư, thu được 13, 44 lít khí (đktc) và chất rắn không tan. Đem đốt cháy chất rắn không tan thu được 24 gam chất bột màu đen.
a. Tính m.
b. Tính % khối lượng mỗi kim loại trong hỗn hợp ban đầu111
Cho 11g hỗn hợp 2 kim loại là M hóa trị II và Al tác dụng với dd H2SO4 loãng, dư. Khi phản ứng kết thu, người ta thu được 8,96 lít khí (đktc)
a/ Viết PTHH
b/ Tính khối lượng muối thu được sau thí nghiệm và tính thể tích dd H2SO4 2M tối thiểu cần dùng
c/ Xác định M biết rằng trong hỗn hợp ban đầu tỉ lệ số mol M:Al là 1:2
hòa tan hoàn toàn hỗn hợp A gồm Al và 1 kim loại M hóa trị II trong dung dịch \(H_2SO_4\) ( loãng)vừa đủ thu được dung dịch B và khí C , cho B tác dụng vừa đủ với dung dịch BaCl2 thấy tách ra 93,2g kết tủa trắng . lọc lấy kết tủa rồi cô cạn nước lọc thu được 36,2g. muối khan
a . tính V khí C thoát ra (đktc) và kim loại của mỗi hỗn hợp A ?
b . xác định kim loại M ? nếu trong hỗn hợp A số mol kim loại M lớn hơn 33,33% số mol của Al
Cho 20,4 gam hỗn hợp gồm Zn, Fe, Al tác dụng với dd chứa HCl và H2SO4 loãng dư thu được 10,08 lít khí H2. Mặt khác 0,2 mol hỗn hợp X tác dụng vừa đủ với 6,16 lít khí Cl2 (đktc). Xác định khối lượng mỗi kim loại trong 20,4 gam X
Trong \(20,4g\) hỗn hợp có: \(\left\{{}\begin{matrix}n_{Zn}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\\n_{Al}=c\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow65a+56b+27c=20,4\left(1\right)\)
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45mol\)
\(BTe:2n_{Zn}+2n_{Fe}+3n_{Al}=2n_{H_2}\)
\(\Rightarrow2a+2b+3c=2\cdot0,45\left(2\right)\)
Trong \(0,2mol\) hhX có \(\left\{{}\begin{matrix}Zn:ka\left(mol\right)\\Fe:kb\left(mol\right)\\Al:kc\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow ka+kb+kc=0,2\)
\(n_{Cl_2}=\dfrac{6,16}{22,4}=0,275mol\)
\(BTe:2n_{Zn}+3n_{Fe}+3n_{Al}=2n_{Cl_2}\)
\(\Rightarrow2ka+3kb+3kc=2\cdot0,275\)
Xét thương:
\(\dfrac{ka+kb+kc}{2ka+3kb+3kc}=\dfrac{0,2}{2\cdot0,275}\Rightarrow\dfrac{a+b+c}{2a+3b+3c}=\dfrac{4}{11}\)
\(\Rightarrow3a-b-c=0\left(3\right)\)
Từ (1), (2), (3)\(\Rightarrow\left\{{}\begin{matrix}a=0,1mol\\b=0,2mol\\c=0,1mol\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}m_{Zn}=6,5g\\m_{Fe}=11,2g\\m_{Al}=2,7g\end{matrix}\right.\)