Đốt cháy 50cm3 một Hidrocacbon = 50 cm3 O2 dư sau khi làm lạnh thu được 375 cm3 hỗn hợp khí. Dẫn tiếp qua KOH dư còn lại 175 cm3. Xác định CTPT của hidrocacbon biết thể tích cá khí đo ở điểu kiện tiêu chuẩn.

Những câu hỏi liên quan
Cho 0,5 lít hỗn hợp gồm hidrocacbon và khí cacbonic vào 2,5 lít oxi (dư) rồi đốt. Thể tích của hỗn hợp thu được sau khi đốt là 3,4 lít. Cho hỗn hợp qua thiết bị làm lạnh, thể tích hỗn hợp khí còn lại 1,8 lít và cho lội qua dung dịch KOH chỉ còn lại 0,5 lít khí. Thể tích các khí được đo trong cùng điều kiện. Tên gọi của hidrocacbon là: A. propan B. xiclobutan C. propen D. xiclopropan
Đọc tiếp
Cho 0,5 lít hỗn hợp gồm hidrocacbon và khí cacbonic vào 2,5 lít oxi (dư) rồi đốt. Thể tích của hỗn hợp thu được sau khi đốt là 3,4 lít. Cho hỗn hợp qua thiết bị làm lạnh, thể tích hỗn hợp khí còn lại 1,8 lít và cho lội qua dung dịch KOH chỉ còn lại 0,5 lít khí. Thể tích các khí được đo trong cùng điều kiện. Tên gọi của hidrocacbon là:
A. propan
B. xiclobutan
C. propen
D. xiclopropan
Giúp cái mọi người
trộn 100ml hidrocacbon A với 700ml O2 dư rồi đốt . Làm lạnh thu được 500ml một hỗn hợp mà khi dẫn qua dung dịch KOH dư chỉ còn 100ml .các khí đo ở cùng điều kiện
a/ xác định công thức phân tử của A
Đốt cháy 1 lít hơi hiđrocacbon với một thể tích không khí (lượng dư). Hỗn hợp khí thu được sau khi hơi H2O ngưng tụ có thể tích là 18,5 lít, cho qua dung dịch KOH dư còn 16,5 lít, cho hỗn hợp khí đi qua ống đựng photpho dư thì còn lại 16 lít. Xác định CTPT của hợp chất trên biết các thể tích khí đo ở cùng điều kiện nhiệt độ, áp suất và O2 chiếm 1/5 không khí, còn lại là N2 A. C2H4 B. C2H6 C. C3H8. D. C2H2
Đọc tiếp
Đốt cháy 1 lít hơi hiđrocacbon với một thể tích không khí (lượng dư). Hỗn hợp khí thu được sau khi hơi H2O ngưng tụ có thể tích là 18,5 lít, cho qua dung dịch KOH dư còn 16,5 lít, cho hỗn hợp khí đi qua ống đựng photpho dư thì còn lại 16 lít. Xác định CTPT của hợp chất trên biết các thể tích khí đo ở cùng điều kiện nhiệt độ, áp suất và O2 chiếm 1/5 không khí, còn lại là N2
A. C2H4
B. C2H6
C. C3H8.
D. C2H2
Đốt cháy 1 lít hơi hiđrocacbon với một thể tích không khí (lượng dư). Hỗn hợp khí thu được sau khi hơi H2O ngưng tụ có thể tích là 18,5 lít, cho qua dung dịch KOH dư còn 16,5 lít, cho hỗn hợp khí đi qua ống đựng photpho dư thì còn lại 16 lít. Xác định CTPT của hợp chất trên biết các thể tích khí đo ở cùng điều kiện nhiệt độ, áp suất và O2 chiếm 1/5 không khí, còn lại là N2. A. C2H6 B. C2H4 C. C3H8 D. C2H2
Đọc tiếp
Đốt cháy 1 lít hơi hiđrocacbon với một thể tích không khí (lượng dư). Hỗn hợp khí thu được sau khi hơi H2O ngưng tụ có thể tích là 18,5 lít, cho qua dung dịch KOH dư còn 16,5 lít, cho hỗn hợp khí đi qua ống đựng photpho dư thì còn lại 16 lít. Xác định CTPT của hợp chất trên biết các thể tích khí đo ở cùng điều kiện nhiệt độ, áp suất và O2 chiếm 1/5 không khí, còn lại là N2.
A. C2H6
B. C2H4
C. C3H8
D. C2H2
Đáp án A
Theo giả thiết, ta có :
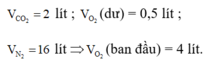
Sơ đồ phản ứng :
CxHy + O2 → CO2 +H2O + O2 dư
lít: 1 4 2 a 0,5
Áp dụng định luật bảo toàn nguyên tố đối với các nguyên tố C, H, O ta có :
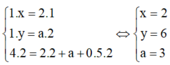
Þ Công thức của hiđrocacbon là C2H6
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 15 cm3 một hidrocacbon A phải dùng hết 82,5 cm3 O2. Các khí thu đc ở đktc. Xác định CTPT A. Biết A có 2 liên kết đôi và tham gia pư trùng hợp
đốt cháy 50 cm3 một hiđrocacbon bằng 500 cm3 dư sau khi làm lạnh thu được 375 cm3 hỗn hợp khí chấm Dẫn hỗn hợp qua KOH dư còn lại 175 cm3 .Các khí đo ở cùng điều kiện về nhiệt độ và áp suất. Các định CTPT của hidrocacbon
Gọi công thức hidrocacbon là CxHy
CxHy+O2\(\rightarrow\)CO2+H2O
Sau khi đốt thu được O2 dư, CO2 và H2O
Sau khi làm lạnh thu được 375ml gồm O2 dư và CO2
(H2O bị ngưng tụ)
Dẫn qua KOH thì CO2 phản ứng
CO2+2KOH\(\rightarrow\)K2CO3+H2O
\(\rightarrow\)Khí thu được là O2 dư 175ml
\(\rightarrow\)VCO2=375-175=200ml
Ta có x=VCO2/VCxHy=200/50=4
Ban đầu có 500ml O2, dư 175ml
\(\rightarrow\)O2 phản ứng 500-175=325ml
Theo bảo toàn O: 2VO2=2VCO2+VH2O
\(\rightarrow\)2.325=2.200+VH2O
\(\rightarrow\)VH2O=250ml
\(\rightarrow\)y=2VH2O/VCxHy=2.250/50=10
\(\rightarrow\)Công thức là C4H10
Đốt 10 cm3 một hiđrocacbon bằng 70 cm3 oxi (lấy du), thu được 90 cm3 sản phẩm khí và hơi. Dẫn sản phẩn khí qua bình đụng Ca(OH)2 (dư), thi còn lại 20 cm3 khí thoát ra. Các thể tích khí đo trong cùng điều kiện. CTPT của hiđrocacbon là
\(20cm^3\) khí thoát ra là \(O_2\)
\(\Rightarrow V_{O_2\left(d\text{ư}\right)}=20\left(cm^3\right)\Rightarrow\left\{{}\begin{matrix}V_{O_2\left(p\text{ư}\right)}=70-20=50\left(cm^3\right)\\V_{CO_2}+V_{H_2O}=90-20=70\left(cm^3\right)\end{matrix}\right.\)
Đặt CTPT của hiđrocacbon là \(C_xH_y\left(x,y\in N\text{*}\right)\)
Vì các khí đo ở cùng điều kiện nên tỉ lệ thể tích cũng là tỉ lệ mol
\(\Rightarrow n_{C_xH_y}:n_{O_2}:\left(n_{CO_2}+n_{H_2O}\right)=V_{C_xH_y}:V_{O_2}:\left(V_{CO_2}+V_{H_2O}\right)=10:50:70=1:5:7\)
\(\Rightarrow\left\{{}\begin{matrix}n_{CO_2}+n_{H_2O}=7n_{C_xH_y}\\n_{O_2}=5n_{C_xH_y}\end{matrix}\right.\)
PTHH: \(C_xH_y+\left(x+\dfrac{y}{4}\right)O_2\xrightarrow[]{t^o}xCO_2+\dfrac{y}{2}H_2O\)
\(\Rightarrow\left\{{}\begin{matrix}x+\dfrac{y}{2}=7\\x+\dfrac{y}{4}=5\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=3\\y=8\end{matrix}\right.\left(TM\right)\)
Vậy CTPT của hiđrocacbon là \(C_3H_8\)
Đúng 2
Bình luận (0)
Đốt cháy 100 cm3 hỗn hợp gồm amin đơn chức A với không khí có dư thì thu được 105 cm3 khí. Cho hơi nước ngưng tụ còn 91 cm3. Cho hỗn hợp qua tiếp dung dịch KOH dư thì còn 83 cm3 Tìm công thức cấu tạo của A Tính % về thể tích của A trong hỗn hợp đầu. Biết các thể tích đo cùng điều kiện, và không khí chứa 80% thể tích N2
Đốt cháy 50 ml hỗn hợp khí X gồm trimetylamin và 2 hiđrocacbon là đồng đẳng liên tiếp bằng oxi vừa đủ, thu được 375 ml hỗn hợp khí và hơi Y. Cho Y đi qua
H
2
S
O
4
đặc dư thì còn lại 175 ml, các thể tích khí đo ở cùng điều kiện. CTPT của 2 hiđrocacbon là A.
C
2
H
6
;
C...
Đọc tiếp
Đốt cháy 50 ml hỗn hợp khí X gồm trimetylamin và 2 hiđrocacbon là đồng đẳng liên tiếp bằng oxi vừa đủ, thu được 375 ml hỗn hợp khí và hơi Y. Cho Y đi qua H 2 S O 4 đặc dư thì còn lại 175 ml, các thể tích khí đo ở cùng điều kiện. CTPT của 2 hiđrocacbon là
A. C 2 H 6 ; C 3 H 8 .
B. C 2 H 4 ; C 3 H 6 .
C. C 3 H 6 v à C 4 H 8 .
D. C 3 H 8 v à C 4 H 10 .
Ta có: V H 2 O = 375 – 175 = 200 m l ; V C O 2 + V N 2 = 175 m l
V H 2 O − V H 2 O − V N 2 = 25 m l = 1 2 n h h
→ 2 hiđrocacbon chỉ có thể là anken và V a m i n = V a n k e n = 25 m l
Đặt công thức chung của 2 anken là C n ¯ H 2 n ¯ + 2
V C O 2 = 25 n ¯ + 3.25 = 25 n ¯ + 75 ; V N 2 = 0 , 5.25 = 12 , 5
→ 25 n ¯ + 75 + 12,5 = 175 → n ¯ = 3,5
Vậy 2 hiđrocacbon là C 3 H 6 v à C 4 H 8
Đáp án cần chọn là: C
Đúng 0
Bình luận (0)
















