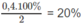Hiện nay, để sản xuất ammoniac, người ta điều chế nitơ và hiđro bằng cách chuyển hóa có xúc tác một hỗn hợp gồm không khí, hơi nước và khí metan (thành phần chính của khí thiên nhiên). Phản ứng giữa khí metan và hơi nước tạo ra hiđro và cacbon đioxit. Để loại khí oxi và thu khí nitơ, người ta đốt khí metan trong một thiết bị kín chứa không khí.
Hãy viết các phương trình hóa học của phản ứng điều chế hiđro, loại khí oxi và tổng hợp khí ammoniac.











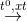 CO2 + 4H2
CO2 + 4H2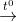 CO2 + 2H2O nên còn lại N2
CO2 + 2H2O nên còn lại N2