Nêu phương pháp điều chế khí clo trong phòng thí nghiệm. Viết phương trình hoá học minh hoạ.

Những câu hỏi liên quan
Nêu phương pháp và vẽ hình mô tả quá trình điều chế khí clo trong phòng thí nghiệm? Viết phương trình hóa học minh họa và giải thích quá trình để thu được khí clo tinh khiết.
- Phương pháp điều chế clo trong phòng thí nghiệm: Đun nóng nhẹ dung dịch HCl đậm đặc với chất oxi hóa mạnh như MnO2 (hoặc KMnO4).
MnO2 + 4HCl \(\underrightarrow{t^o}\) MnCl2 + Cl2 + 2H2O
Để thu được khí clo tinh khiết:
- Bình H2SO4 đặc có tác dụng làm khô khí clo.
- Clo nặng hơn không khí Þ Thu bằng cách đẩy không khí.
- Bông tẩm xút: tránh để clo độc bay ra ngoài.
Đúng 0
Bình luận (0)
Nêu tính chất hoá học, nguyên liệu điều chế hidro trong phòng thí nghiệm. Viết PTHH minh hoạ.
Nêu tính chất hoá học, nguyên liệu điều chế hidro trong phòng thí nghiệm. Viết PTHH minh hoạ.
- Tính chất hoá học:
+ Phản ứng với O2 ---> nước: \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
+ Phản ứng với phi kim ---> hợp chất khí (axit không có oxi):
\(H_2+Cl_2\underrightarrow{\text{ánh sáng}}2HCl\)
\(H_2+S\underrightarrow{t^o}H_2S\)
+ Phản ứng với oxit kim loại (đứng sau Al) ---> kim loại + nước:
\(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\\ Ag_2O+H_2\underrightarrow{t^o}2Ag+H_2O\)
- Điều chế:
+ Nguyên liệu: Mg, Al, Pb, Zn, Fe, HCl, H2SO4 (loãng),...
+ Phương pháp: cho kim loại + axit ---> muối + H2
\(Mg+2HCl\rightarrow MgCl_2+H_2\\ 2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ Zn+2HCl\rightarrow ZnCl_2+H_2\\ Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
Đúng 2
Bình luận (0)
td với Oxi
\(2H_2+O_2\underrightarrow{t^o}2H_2O\)
td với 1 số oxit kim loại
\(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
điều chế khí Hidro bằng cách cho kim loại td với axit
Đúng 3
Bình luận (0)
Hình vẽ 3.5 là thiết bị điều chế khí clo trong phòng thí nghiệm.X và Y là những chất nào trong số các chất sau ?X :
H
2
O
, dd HCl, dd
H
2
SO
4
, dd NaOH, dd NaCl.Y : NaCl,
CaCO
3
, Mn
O
2...
Đọc tiếp
Hình vẽ 3.5 là thiết bị điều chế khí clo trong phòng thí nghiệm.
X và Y là những chất nào trong số các chất sau ?
X : H 2 O , dd HCl, dd H 2 SO 4 , dd NaOH, dd NaCl.
Y : NaCl, CaCO 3 , Mn O 2 , Cu Cl 2 , Na 2 SO 4 , KMn O 4
Viết phương trình hoá học điều chế khí clo từ những chất đã chọn ở trên.
X là : dd HCl
Y là : Mn O 2 , KMn O 4
Phương trình hoá học của phản ứng điều chế clo.
Mn O 2 + 4HCl → Mn Cl 2 + 2 H 2 O + Cl2
2KMn O 4 + 16HCl → 2KCl + 2Mn Cl 2 + 5 Cl 2 + 8 H 2 O
Đúng 0
Bình luận (0)
Trong phòng thí nghiệm có các hoá chất sau :
Dung dịch HCl, KMn O 4 , Mn O 2 , NaCl, H 2 O.
Để điều chế clo, em có thể dùng những hoá chất nào ? Viết các phương trình hoá học.
4HCl + Mn O 2 → Mn Cl 2 + Cl 2 + 2 H 2 O
16HCl + 2KMn O 4 → 2KCl + 2Mn Cl 2 + 5 Cl 2 + 8 H 2
2NaCl + 2 H 2 O → 2NaOH + H 2 + Cl 2
Đúng 0
Bình luận (0)
trình bày phương pháp hoá học nhận biết khí oxi cách điều chế khí oxi trong phòng thí nhiệm
refer
Điều chế, sản xuất Oxi (O2) trong phòng thí nghiệm và trong công nghiệp - hoá 8 bài 27
bấm vào ^
Đúng 1
Bình luận (1)
nhận biết khí Oxi bằng cách cho que đóm đang cháy vào lọ chứa khí Oxi
chúng sẽ cháy to
điều chế oxi bằng cách phân hủy cách chất giàu oxi và dễ phân hủy
điều chế Oxi bằng 2 phương pháp : đẩy nước và đẩy không khí
lưu ý : khi đẩy không khí ta phải để bình đựng khí ở trạng thái ngửa vì Oxi nặng hơn không khí
Đúng 0
Bình luận (0)
Hãy trình bày các phương pháp điều chế khí oxi trong phòng thí nghiệm và trong công nghiệp. Tại sao không áp dụng phương pháp điều chế khí trong phòng thí nghiệm, và ngược lại?
Điều chế oxi:
- Trong phòng thí nghiệm, oxi được điều chế bằng cách phân hủy những hợp chất giàu Oxi và ít bên với nhiệt như KMnO4, KClO3, ...
2KMnO4 → K2MnO4 + MnO2 + O2
2KClO3 → 2KCl + 3O2
- Trong công nghiệp:
a) Từ không khí: Không khí sau khi đã loại bỏ hết hơi nước, khí CO2, được hóa lỏng dưới áp suất 200 atm đồng thời hạ thấp nhiệt độ. Chưng cất phân đoạn không khí lỏng, thu được oxi lỏng. Oxi lỏng được vận chuyển trong những bình thép có thể tích 100 lít dưới áp suất 150atm.
b) Từ nước. Điện phân nước: 2H2O
Người ta không áp dụng phương pháp phòng thí nghiệm cho phòng thí nghiệm vì trong phòng thí nghiệm chỉ điều chế lượng nhỏ oxi, còn công nghiệp cần một lượng lớn giá thảnh rẻ.
Đúng 0
Bình luận (0)
Khí CO sinh ra thường có lẫn một phần khí CO2. Hãy giới thiệu hai phương pháp hoá học có thể thu được khí CO trong phòng thí nghiệm và viết các phương trình hoá học.
- Dẫn hỗn hợp khí CO và CO 2 đi qua dung dịch NaOH hoặc Ca OH 2 . Khí ra khỏi dung dịch kiềm là khí CO vì khí CO 2 đã tác dụng với dung dịch NaOH hoặc Ca OH 2
CO 2 + 2NaOH → Na 2 CO 3 + H 2 O
CO 2 + Ca OH 2 → CaCO 3 + H 2 O
- Hoặc dẫn hỗn hợp khí qua canxi oxit (CaO), khí đi ra là khí CO.
Đúng 0
Bình luận (0)
Cho hình vẽ điều chế oxi trong phòng thí nghiệm: – Viết phương trình hóa học của phản ứng. – Vì sao có thể thu khí oxi bằng phương pháp đẩy nước? – Vì sao miệng ống nghiệm đựng KMnO4 lắp hơi nghiêng xuống? – Nêu vai trò của bông khô? – Khi dừng thí nghiệm nên tắt đèn cồn trước hay tháo ống dẫn khí ra trước? Tại sao?
Đọc tiếp
Cho hình vẽ điều chế oxi trong phòng thí nghiệm:
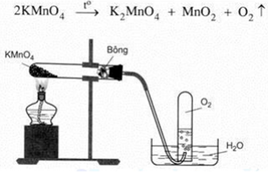
– Viết phương trình hóa học của phản ứng.
– Vì sao có thể thu khí oxi bằng phương pháp đẩy nước?
– Vì sao miệng ống nghiệm đựng KMnO4 lắp hơi nghiêng xuống?
– Nêu vai trò của bông khô?
– Khi dừng thí nghiệm nên tắt đèn cồn trước hay tháo ống dẫn khí ra trước? Tại sao?
– Dùng phương pháp đẩy nước là hợp lí vì oxi ít tan trong nước và oxi thu được có độ tinh khiết cao.
– Oxi nặng hơn không khí, khi đốt nóng KMnO4 thì áp suất tại đó cao hơn nên
– Oxi sinh ra sẽ di chuyển xuống phía dưới ống nơi áp suất thấp hơn và dễ dàng thoát ra ống dẫn khí. – Bông khô có vai trò hút ẩm.
– Khi dừng thí nghiệm nên tắt đèn cồn trước sau đó mới tháo ống dẫn khí.
Đúng 0
Bình luận (0)