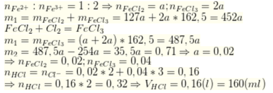Cho 15g hỗn hợp Al, Mg đem chia làm 2 phần bằng nhau cho một nửa vài 600ml dung dịch HCl thu được khí A và dung dịch B THU Được 27,9g hỗn hợp muối khan và cho một nửa còn lại vào 800ml dung dịch HCl thu dk 32,5g muối khan
Xác định khối lượng mỗi kim loại trong hỗn hợp
Tính Vh2 dktc ở tn2