bằng cách nào có được 200g dd BaCl2 5%

Những câu hỏi liên quan
Bằng cách nào có được 200g dung dịch BaCl2 5%. A. Hòa tan 190g BaCl2 trong 10g nước. B. Hòa tan 10g BaCl2 trong 190g nước. C. Hoàn tan 100g BaCl2 trong 100g nước. D. Hòa tan 200g BaCl2 trong 10g nước. E. Hòa tan 10g BaCl2 trong 200g nước.
Đọc tiếp
Bằng cách nào có được 200g dung dịch BaCl2 5%.
A. Hòa tan 190g BaCl2 trong 10g nước.
B. Hòa tan 10g BaCl2 trong 190g nước.
C. Hoàn tan 100g BaCl2 trong 100g nước.
D. Hòa tan 200g BaCl2 trong 10g nước.
E. Hòa tan 10g BaCl2 trong 200g nước.
Câu trả lời đúng: B.
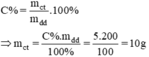
mdd = mct + mnước ⇒ mnước = mdd - mct = 200g – 10g = 190g
Đúng 0
Bình luận (0)
1.Trình bày cách pha chế 200g dd BaCl2 10% từ BaCl2.2H2O và dd Bacl2 5%
Xem chi tiết
* Tính toán :
Gọi \(n_{BaCl_2.2H_2O} = a(mol) ; m_{dd\ BaCl_2\ 5\%} = b(gam)\)
Ta có :
\(m_{dd} = m_{BaCl_2.2H_2O} + m_{dd\ BaCl_2\ 5\%} = 244a + b=200(gam)\)
\(m_{BaCl_2} = 208a + b.5\% = 200.10\%(gam)\)
Suy ra: \(a= \dfrac{50}{979};b = 187,54\)
\(\Rightarrow m_{BaCl_22.H_2O} = \dfrac{50}{979}.244 = 12,46(gam)\)
* Pha chế :
- Cho 12,46 gam BaCl2.2H2O và 187,54 gam dung dịch BaCl2, khuấy đều. Ta được 200 gam dung dịch BaCl2 10%
Đúng 3
Bình luận (0)
Cho 200g dd HCl 14,6% tác dụng với 200g dd Ba(OH)2 17,1%. Tính nồng độ% của các chất có trong dd thu được. HCl+Ba(OH)2-> BaCl2 +H2O
nHCl=(200.14,6%)/100=0,8(mol)
nBa(OH)2=(17,1%.200)/100=0,2(mol)
PTHH: Ba(OH)2 +2 HCl -> BaCl2 + 2 H2O
Ta có: 0,8/2 > 0,2/1
=> HCl dư, Ba(OH)2 hết=> Tính theo nHCl
=> nBaCl2=nBa(OH)2=0,2(mol) => mBaCl2= 208.0,2= 41,6(g)
nHCl(dư)=0,8 - 0,2.2=0,4(mol) => mHCl(dư)=0,4.36,5=14,6(g)
mddsau= 200+200=400(g)
C%ddBaCl2=(41,6/400).100=10,4%
C%ddHCl(dư)= (14,6/400).100=3,65%
Chúc em học tốt!
Đúng 3
Bình luận (1)
300g dd H2SO4 9,8% tác dụng với 200g dd BaCl2 , nồng độ % của dung dịch thu được là
\(n_{H_2SO_4}=\dfrac{300.9,8\%}{98}=0,3\left(mol\right)\\ BaCl_2+H_2SO_4\rightarrow BaSO_4\downarrow+2HCl\\ n_{HCl}=0,3.2=0,6\left(mol\right)\\ n_{BaSO_4}=n_{H_2SO_4}=0,3\left(mol\right)\\ m_{ddsau}=m_{ddBaCl_2}+m_{ddH_2SO_4}-m_{BaSO_4}=200+300-233.0,3=430,1\left(g\right)\\ C\%_{ddHCl}=\dfrac{0,6.36,5}{430,1}.100\approx5,092\%\)
Đúng 4
Bình luận (0)
Trộn 200g dd CuSO4 32°/• với 200g dd BaCl2 10,4 °/• a) viết ptpư b) tính khối lượng chất rắn sinh ra c) tính C °/• các chất có trong dd sau phản ứng
\(m_{CuSO_4}=\dfrac{200\cdot32}{100}=64\left(g\right)\)\(\Rightarrow n_{CuSO_4}=\dfrac{64}{160}=0,4mol\)
\(m_{BaCl_2}=\dfrac{200\cdot10,4}{100}=20,8\left(g\right)\)\(\Rightarrow n_{BaCl_2}=\dfrac{20,8}{208}=0,1mol\)
\(CuSO_4+BaCl_2\rightarrow BaSO_4\downarrow+CuCl_2\)
0,4 0,1 0,1 0,1
b)\(m_{BaSO_4}=0,1\cdot233=23,3\left(g\right)\)
c)\(m_{CuCl_2}=0,1\cdot135=13,5\left(g\right)\)
\(\Rightarrow m_{ddsau}=200+200-13,5=386,5\left(g\right)\)
\(\Rightarrow C\%=\dfrac{23,3}{386,5}\cdot100\%=6,028\%\)
Đúng 0
Bình luận (2)
Cho 200g dd bacl2 20,8% vào 300g dd h2so4 19,6% sau pư thu được kết tủa a và dd b
tính gam kết tủa a
Chờ 200g dd bacl2 ,20,8% tác dụng vừa đủ với dd na2(so)4 dư . Tính khối lượng kết tủa thu được
\(m_{ct}=\dfrac{20,8.200}{100}=41,6\left(g\right)\)
\(n_{BaCl2}=\dfrac{41,6}{208}=0,2\left(mol\right)\)
Pt : \(BaCl_2+Na_2SO_4\rightarrow BaSO_4+2HCl|\)
1 1 1 2
0,2 0,2
\(n_{BaSO4}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
⇒ \(m_{BaSO4}=0,2.233=46,6\left(g\right)\)
Chúc bạn học tốt
Đúng 1
Bình luận (1)
Trộn 300g dd H2SO4 9,8% với 200g dd BaCl2 26%, thu được a gam kết tủa và dd X a) Viết PTHH. Tính ab) Xác định nồng độ % các chất trong dd Xc) Toàn bộ dd X được trung hoà bằng V lít dd NaOH 1M. Tính V Bài 4: Ngâm 1 lá kẽm trong 32g dd CuSO4 10% cho tới khi kẽm không thể tan được nữa. a) Viết PTHH. Phản ứng trên thuộc loại phản ứng gì?b) Tính khối lượng kẽm đã phản ứng.c) Xác định nồng độ % của dd sau phản ứng.
Đọc tiếp
Trộn 300g dd H2SO4 9,8% với 200g dd BaCl2 26%, thu được a gam kết tủa và dd X a) Viết PTHH. Tính a
b) Xác định nồng độ % các chất trong dd X
c) Toàn bộ dd X được trung hoà bằng V lít dd NaOH 1M. Tính V
Bài 4: Ngâm 1 lá kẽm trong 32g dd CuSO4 10% cho tới khi kẽm không thể tan được nữa. a) Viết PTHH. Phản ứng trên thuộc loại phản ứng gì?
b) Tính khối lượng kẽm đã phản ứng.
c) Xác định nồng độ % của dd sau phản ứng.
Cho 200g dung dich H2SO4 19,6% vào 200ml dd BaCl2 1,5M. Sau pứ hoàn toàn
a) Tính khối lượng kết tủa thu được
b) Tính nồng độ % của các chất có trong dd thu đc sau pứ (biết KLR của BaCl2 là 1,1g/ml)



















