Trong phân tử NaCl, điện hóa trị của Na và Cl lần lượt là
A. 1+ và 1-
B. +1 và +1
C. -1 và -1
D. -1 và +1
Trong phân tử NaCl, điện hóa trị của Na và Cl lần lượt là
A. 1+ và 1-
B. +1 và +1
C. -1 và -1
D. -1 và +1
Chọn A
Người ta quy ước, khi viết điện hóa trị của nguyên tố, ghi giá trị điện tích trước, dấu của điện tích sau.
→ Vậy trong phân tử NaCl thì Na có điện hóa trị 1+; Cl có điện hóa trị 1-.
Viết sơ đồ hình thành liên kết tạo hợp chất ion NaCl . Xác định điện hóa trị của Na và Cl trong hợp chất đó cho số liệu nguyên tử của Na và Cl lần lượt là 11 và 17 b. Viết công thức cấu tạo của hợp chất cộng hóa trị CO2 , H2O . Cho H(Z=1) ; C(Z=6) ; O(Z=8)
1. Xác định hóa trị của Fe và nhóm NO3 lần lượt trong các hợp chất FeCl2 ( biết Cl hóa trị I), HNO3
2. a) Lập phương trình hóa học sau:
Fe(OH)3 → Fe2O3 + H2O
b) Xác định tỉ lệ số phân tử Fe(OH)3 và số phân tử Fe2O3; số phân tử Fe(OH)3 và số phân tử H2O
1) Fe trong FeCl2 mang hóa trị II
Nhóm NO3 trong HNO3 mang hóa trị I
2)
a) PTHH: \(2Fe\left(OH\right)_3\underrightarrow{t^o}Fe_2O_3+3H_2O\)
b)
+) Fe(OH)3 có số phân tử là 7 và tỉ lệ Fe : O : H = 1 : 3 : 3
+) Fe2O3 có số phân tử là 5 và tỉ lệ Fe : O = 2 : 3
+) H2O có số phân tử là 3 và tỉ lệ H : O = 2 : 1
Câu 2: Cho H (Z=1), K (Z=19) và Cl (Z=17)
a. Xác định loại liên kết hóa học trong phân tử HCl, KCl .
Biết độ âm điện của H=2,2; K=0,82; Cl=3,16
b. Viết sơ đồ hình thành phân tử HCl và KCl
c. Xác định cộng hóa trị trong hợp chất HCl và điện hóa trị trong hợp chất KCl
Trong 1 mol phân tử X có 1 mol Na và 1 mol Cl. Công thức phân tử của X là
Liên kết hóa học trong NaCl được hình thành là do.
A. Hai hạt nhân nguyên tử hút electron rất mạnh.
B. Mỗi nguyên tử Na và Cl góp chung 1 electron.
C. Mỗi nguyên tử đó nhường hoặc thu electron để trở thành các ion trái dấu hút nhau.
D. Na → Na+ e ; Cl + e → Cl- ; Na+ + Cl- → NaCl.
Chọn đáp án đúng nhất
Cho các phân tử sau: KCl, H 2 O , N 2 và N a 2 O .
Biết số hiệu nguyên tử của các nguyên tố lần lượt là: H = 1, N = 7, O = 8, Na = 11, Cl = 17, K = 19.
Viết công thức electron và công thức cấu tạo của các phân tử chứa liên kết cộng hoá trị.
Viết CT electron và công thức cấu tạo của phân tử chứa liên kết cộng hoá trị: N 2 và H 2 O (1,0 điểm)

ion Na+ và Cl- trong nước có thể tính theo công thức: v=μE trong đó E là cường độ điện trường, μ là độ linh động có giá trị lần lượt là 4,5.10-8 m2/ V.s. Tính điện trở suất của dung dịch NaCl nồng độ 0,1 mol/l, cho rằng toàn bộ các phần tử NaCl đều phân li thành icon.
n1 là mật độ hạt tải điện ion Na+; n2 = mật độ hạt tải điện là ion Cl-.
σ là độ dẫn điện; ρ = 1/ σ là điện trở suất.
Vì Na+ nhẹ hơn Cl- nên có độ linh động μ+ > μ-;
μ+ = 6,8.10-8 m2/ V.s; μ- = 4,5.10-8 m2/ V.s
Khi phân li, số ion Na+ bằng số ion Cl-. Do đó, theo đề:
n0 là nồng độ của dung dịch NaCl:
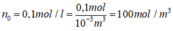
→ n1 = n2 = n = n0.NA = 100.6,02.1023 = 6,02.1025 hạt/m3
Tốc độ chuyển động có hướng của các ion trong nước có thể tính theo công thức: v = μ.E
Mà ta có: 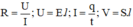 nên ta được:
nên ta được:
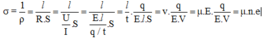
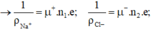
Độ dẫn điện của dung dịch NaCl là:
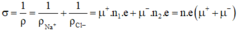
→ Điện trở suất của dung dịch NaCl:
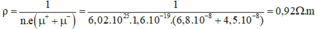
Clo trong tự nhiên có 2 đồng vị là 35 Cl và 37 Cl. Biết nguyên tử khối trung bình của Na và Cl lần lượt là 23 và 35,5. Tính phần trăm về khối lượng của 35 Cl trong NaCl.
Gọi phần trăm đồng vị của 35Cl là x
⇒ Phần trăm đồng vị của 37Cl là 100-x
Ta có: \(A=\dfrac{35x+37\left(100-x\right)}{100}=35,5\Rightarrow x=75\%\)
Phần trăm k/lg của 35Cl trong NaCl là:\(\dfrac{35.75\%}{23+35,5}.100\%=44,87\%\)
Em hãy tìm khối lượng của:
a) 1 mol nguyên tử Cl và 1 mol phân tử Cl2.
b) 1 mol nguyên tử Cu và 1 mol phân tử CuO.
c) 1 mol nguyên tử C, 1 mol phân tử CO, 1 mol phân tử CO2.
d) 1 mol phân tử NaCl và 1 mol phân tử C12H22O11 (đường).
a) MCl = 35,5g ; MCl2 = 71g.
b) MCu = 64g ; MCuO = (64 + 16)g = 80g.
c) MC = 12g ; MCO = (12 + 16)g = 28g, MCO2 = (12 + 16.2) = 44g.
d) MNaCl = (23+ 35,5) = 58,5g, MC12H22O11 = 12.12 + 1.22 + 16.11 = 342g.