Mình cần lý thuyết,,,,,,
1. Trình bày cách pha chế 1 dung dịch theo nồng độ cho trước.
2. Trình bày cách pha loãng 1 dung dịch theo nồng độ cho trước.
Hãy trình bày cách pha chế các dung dịch theo những yêu cầu sau:
200g dung dịch có nồng độ 10% của mỗi chất nói trên.
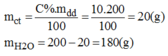
* NaCl: Cân lấy 20g NaCl cho vào bình tam giác. Cân lấy 180g nước cất rồi đổ dần dần vào cốc và khuấy nhẹ cho NaCl tan hết. Được 200g dung dịch NaCl 10%.
* K N O 3 : Cân lấy 20g K N O 3 ch vào bình tam giác. Cân lấy 180g nước cất rồi đổ vào bình. Lắc mạnh cho H N O 3 tan hết, ta dược 200g dung dịch K N O 3 10%.
* C u S O 4 ; Cân lấy 20g C u S O 4 cho vào bình tam giác. Cân lây 180g nước cất rồi đổi vào bình. Lắc mạnh cho C u S O 4 tan hết ta được 200g dung dịch C u S O 4 10%.
Hãy trình bày cách pha chế các dung dịch theo những yêu cầu sau:
250ml dung dịch có nồng độ 0,1M của những chất sau: NaCl, K N O 3 , C u S O 4
n = C M .V = 0,1.0,25 = 0,025(mol)
* NaCl: m N a C l = n.M = 0,025.58,5 = 1,4625(g)
- Cách pha chế:
+ Cân lấy 1,4625g NaCl cho cốc và khuây nhẹ cho đủ 250ml dung dich. Ta được 250ml dung dịch NaCl 0,1M.
* K N O 3 : m K N O 3 = n.M = 0,025.101 = 2,525(g)
- Cách pha chế:
+ Cân lấy 2,525g K N O 3 cho vào cốc thủy tinh có dung tích 300ml. Đổ từ từ nước cất vào cốc và khuấy đều cho đến khi đủ 250ml dung dịch, ta được 250ml dung dịch K N O 3 0,1M.
* C u S O 4 : m C u S O 4 = 0,025.160=4(g)
- Cách pha chế: Cân lấy 4g C u S O 4 cho vào bình chia độ có dung tích 300ml, đổ từ từ nước cất vào bình và khuấy nhẹ cho đến khi đủ 250ml dung dịch C u S O 4 0,1M.
Có 2 lọ đựng dung dịch H 2 S O 4 . Lọ thứ nhất có nồng độ 1mol/l, lọ thứ hai có nồng độ 3 mol/l. Hãy tính toán và trình bày cách pha chế 50ml dung dịch H 2 S O 4 có nồng độ 1,5mol/l từ 2 dung dịch axit đã cho.
Pha chế 50ml dung dịch H 2 S O 4 1,5M.
- Số mol H 2 S O 4 cần pha chế 50ml dung dịch H 2 S O 4 1,5M:
n H 2 S O 4 = CM.V = 1,5.0,05 = 0,075 (mol)
Gọi x(ml) là thể tích của dung dịch H 2 S O 4 1M (1)
Gọi y(ml) là thể tích của dung dịch H 2 S O 4 3M (2)
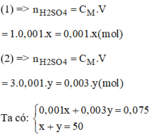
Giải hệ phương trình ta có: x = 37,5ml; y = 12,5ml
- Cách pha chế:
+ Đong lấy 37,5ml dung dịch H 2 S O 4 1M và 12,5ml dung dịch H 2 S O 4 3M cho vào bình, lắc đều, ta được 50ml dung dịch H 2 S O 4 1,5M.
Ai giúp em với a/ Tìm khối lượng nước, đường có trong 120g dung dịch nước đường có nồng độ 5% b/ Trình bày cách pha chế 200g dung dịch nước đường có nồng độ 10%
a) Khối lượng đường là
120 . 5% = 6g
Khối lượng nước là :
120 - 6 = 114g
b) Cách pha chế
Cần số gam đường là : 200.10% = 20g
Số gam nước là : 200 - 20 = 180g
Vậy cần 20g đường và 180g nước để pha chế
a)
\(m_{đường} = 120.5\% = 6(gam)\\m_{nước} = m_{dung\ dịch} - m_{đường} = 120 -6 = 114(gam)\)
b)
\(m_{đường} =200.10\% = 20(gam)\\ m_{nước} = 200 -20 = 180(gam)\)
Pha chế :
Cân lấy 20 gam đường cho vào cốc dung tích khoảng 3 lít
Đong lấy 180 gam nước cho vào cốc, khuấy đều.
có dung dịch muối ăn nacl 20% và 150gam dung dịch nacl 35%. Trình bày cách pha chế để thu ddc dung dịch X có nồng độ 25%
Hãy tính toán và trình bày cách pha chế 0,5lit dung dịch H 2 S O 4 có nồng độ 1mol/l từ H 2 S O 4 có nồng độ 98%, khối lượng riêng là 1,84g/ml.
* Số mol của H 2 S O 4 cần để pha chế 500ml dung dịch H 2 S O 4 1M:
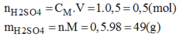
* Khối lượng H 2 S O 4 98% có chứa 49g H 2 S O 4 :
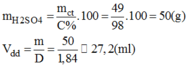
* Cách pha chế: Đổ khoảng 400ml nước cất vào cốc có chia độ có dung tích khoảng 1lit. Rót từ từ 27,2ml H 2 S O 4 98% vào cốc khuấy đều. Sau đó thêm dần dần nước cất vào cốc cho đủ 500ml. ta pha chế được 500ml dung dịch H 2 S O 4 1M.
Hãy trình bày cách pha chế 150ml dung dịch H N O 3 0,25M bằng cách pha loãng dung dịch H N O 3 5M có sẵn
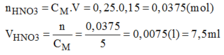
* Cách pha chế:
- Đong lấy 7,5ml dung dịch H N O 3 5M cho vào bình chứa.
- Cho thêm dần dần nước cất vào bình cho đến đủ 150ml lắc đều, ta được 150m dung dịch H N O 3 cần pha chế.
Bài 4: Cho biết ở 200 C độ tan của NaCl là 32g để được dung dịch NaCl bão hòa ở nhiệt độ này ta cần. Nêu cách pha chế dung dịch đó.
Bài 5: Cho 6,5 g kẽm vào 300ml dung dịch H2SO4 loãng có nồng độ 1M
a. Viết phương trình phản ứng xảy ra.
b. Tính số mol các chất có trong dung dịch sau phản ứng.
c. Tính nồng độ mol của các chất sau phản ứng. Coi thể tích dung dịch không đổi.
Bài 6: Biết độ tan của muối ăn (NaCl) ở 25oC là 36 g. Tính nồng độ phần trăm của dung dịch NaCl bão hòa ở nhiệt độ đó.(giúp mình mai thi gấp huhu>:-<<< )
Bài 4 :
- Cân lấy 32 gam NaCl vào cốc
- Đong lấy 100 gam nước cho vào cốc, khuấy đều.
Bài 6 :
\(C\%_{NaCl} = \dfrac{S}{S + 100}.100\% = \dfrac{36}{136}.100\% = 26,47\%\)
Bài 6: ta có mdd=36+100=136( ct-36g, dm là nước 100g)
\(C\%=\dfrac{36}{136}\cdot100\%=26\%\)
Nêu cách pha chế 1 dung dịch theo nồng độ % và nồng độ mol cho trước. Áp dụng tính toán và trình bày cách pha.
a) 200 g dung dịch CuSO4 4%.
b) 150 ml dung dịch NaOH 1M.
Mn giúp em với ạ, em đang cần gấp!