Em hãy kể tên 5 di sản văn hoá phi vật thể của Việt Nam được UNESCO công nhận là di sản văn hoá phi vật thể đại diện của nhân loại?

Em hãy kể tên 5 di sản văn hoá phi vật thể của Việt Nam được UNESCO công nhận là di sản văn hoá phi vật thể đại diện của nhân loại?

-Đờn ca tài tử Nam bộ
-Nhã nhạc cung đình Huế
-Hát xoan Phú Thọ
-Dân ca quan họ Bắc Ninh
-Không gian văn hóa cồng chiêng Tây Nguyên
.......
5 di sản văn hóa phi vật thể cả Việt Nam đước UNESCO công nhận là di sản văn hóa phi vật thể đại diện của nhân loại là:
`+` Dân ca quan họ Bắc Ninh.
`+` Hát Xoan.
`+` Dân ca Ví, Giặm Nghệ Tĩnh.
`+` Ca trù.
`+` Đờn ca tài tử Nam Bộ.
`+` ...
Trong thành phần của một số loại sơn có triester của glycerol với linoleic acid C17H31COOH và linoleic acid C17H29COOH. Số triester có thể có của hai acid trên với glycerol là bao nhiêu?
(Gợi ý viết 6 công thức)
-Công thức 1: Ba nhóm -OH của glycerol đều kết hợp với (linoleic acid):
=> \(C_3H_5\left(O-C_{17}H_{31}COO\right)_3\)
-Công thức 2: Ba nhóm -OH của glycerol đều kết hợp với linoleic acid (\(C_{17}H_{29}COOH\)):
=> \(C_3H_5\left(O-C_{17}H_{29}COO\right)_3\)
-Công thức 3: Hai nhóm -OH của glycerol kết hợp với \(C_{17}H_{31}COOH\), nhóm -OH còn lại kết hợp với \(C_{17}H_{29}COOH\):
=> \(C_3H_5\left(O-C_{17}H_{31}COO\right)_2\left(O-C_{17}H_{29}COO\right)\)
-Công thức 4: Hai nhóm -OH của glycerol kết hợp với \(C_{17}H_{29}COOH\), nhóm -OH còn lại kết hợp với \(C_{17}H_{31}COOH\):
=> \(C_3H_5\left(O-C_{17}H_{29}COO\right)_2\left(O-C_{17}H_{31}COO\right)\)
-Công thức 5: Một nhóm -OH của glycerol kết hợp với \(C_{17}H_{31}COOH\), hai nhóm -OH còn lại kết hợp với \(C_{17}H_{29}COOH\):
=> \(C_3H_5\left(O-C_{17}H_{31}COO\right)\left(O-C_{17}H_{29}COO\right)\)
-Công thức 6: Một nhóm -OH của glycerol kết hợp với \(C_{17}H_{29}COOH\), hai nhóm -OH còn lại kết hợp với \(C_{17}H_{31}COOH\):
=> \(C_3H_5\left(O-C_{17}H_{29}COO\right)\left(O-C_{17}H_{31}COO\right)\)
Đơn giản thế này:
\(u=\left|x^2-3x+2\right|+2m\)
Để ý cái đầu tiên: hàm \(f\left(x\right)\) và hàm u thì ngoài cùng bên phải đều tăng lên dương vô cùng, nên ta chỉ cần quan tâm duy nhất đoạn cuối của cực trị (nghĩa là \(y=f\left(u\right)\) có các cực trị \(x_1< x_2< ...< x_n\) thì nó luôn đồng biến trên \(\left(x_n;+\infty\right)\Rightarrow\) đây là thứ ta quan tâm: nghiệm lớn nhất của \(f'\left(u\right)\), để thỏa mãn thì \(\left(2;+\infty\right)\subset\left(x_n;+\infty\right)\Rightarrow x_n\le2\)
BBT u:
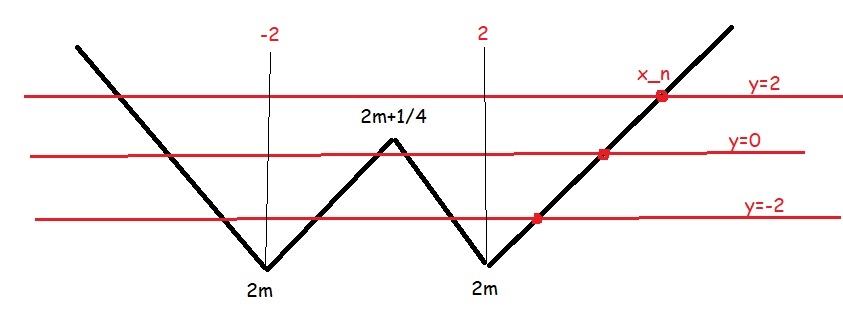
Nhìn BBT thấy ngay:
Nếu ít nhất 1 trong 3 đường thẳng \(y=-2;0;2\) cắt đồ thị u \(\Rightarrow x_n>2\) (ktm)
Do đó bài toán chỉ thỏa mãn khi đường \(y=2\) tiếp xúc hoặc thấp hơn đồ thị u
\(\Rightarrow2m\ge2\Rightarrow m\ge1\)
hòa tan 11,8g hỗn hợp gồm 2 Al và Cu bởi HNO3 đặc.dung dịch thu đc sau pư tác dụng hết với 2,8 lít dung dịch NH3 0,5M thì thu đc một kết tủa, nung kết tủa đó đến khối lượng ko đổi thì đc 10,2g một chất rắn.biết NO2 là chất khử duy nhất. tìm mol HNO3 đã dùng
\(10,2\left(g\right)A\xrightarrow[O_2]{t^o}\left\{{}\begin{matrix}CO_2\\H_2O\end{matrix}\right.+Ba\left(OH\right)_2\rightarrow\left\{{}\begin{matrix}59,1\left(g\right)\downarrow BaCO_3\\m_{dd.giảm}=28,1\left(g\right)\end{matrix}\right.\)
Đun nóng phần nước lọc lại thấy xuất hiện thêm kết tủa
=> Phần nước có dung dịch \(Ba\left(HCO_3\right)_2\)
\(\left\{{}\begin{matrix}n_{BaCO_3\left(1\right)}=\dfrac{59,1}{197}=0,3\left(mol\right)\\n_{BaCO_3\left(2\right)}=\dfrac{19,7}{197}=0,1\left(mol\right)\end{matrix}\right.\)
\(Ba\left(HCO_3\right)\underrightarrow{t^o}BaCO_3+H_2O+CO_2\)
0,1<------------- 0,1
Bình chứa dung dịch sau khi cho sản phẩm cháy vào gồm:
\(\left\{{}\begin{matrix}Ba\left(HCO_3\right)_2\left(dd\right)\\BaCO_3\downarrow\end{matrix}\right.\)
Bảo toàn C: \(n_{CO_2}=0,3+0,1.2=0,5\left(mol\right)\)
\(m_{dd.giảm}=28,1=m_{BaCO_3\left(1\right)}-m_{CO_2}-m_{H_2O}\)
=> \(n_{H_2O}=\dfrac{28,1-59,1+0,5.44}{-18}=0,5\left(mol\right)\)
Có \(m_A=10,2\Rightarrow10,2-m_{H\left(A\right)}-m_{C\left(A\right)}=10,2-0,5.12-0,5.2=3,2\left(g\right)\)
=> Trong A có Oxi
Theo tỉ lệ có: \(n_C:n_H:n_O=0,5:1:\dfrac{3,2}{16}=0,5:1:0,2=5:10:2\)
=> CTPT của A: \(C_5H_{10}O_2\)
Khí A màu vàng lục, mùi xốc có khối lượng riêng là 3,09 g/mL ở 11oC, được hấp thụ bởi lượng dung dịch KOH cùng số mol, tạo nên hỗn hợp hai muối có tỉ lệ mol là 1 : 1. Khi cô cạn dung dịch thu được hai muối có tỉ lệ mol lệ mol là 1 : 5. Hòa tan hai muối này vào nước, lấy \(\dfrac{1}{5}\) lượng dung dịch, cho tác dụng với dung dịch, cho tác dụng với dung dịch AgNO3, thu được 0,0956 gam kết tủa trắng, không tan trong acid. Lấy lượng \(\dfrac{1}{5}\) khác của dung dịch trên, thêm một lượng dư dung dịch KI (đã acid hóa), dung dịch trở nên có màu xanh khi thêm vài giọt hồ tinh bột. Muốn làm mất màu của dung dịch, cần dùng 99,9 mL dung dịch Na2S2O3 0,20M.
a) Hỏi A là khí gì và phân tử có công thức tạo như thế nào?
b) Ở 0oC, chất A có khối lượng riêng là 1,64 g/mL. Giải thích giá trị khối lượng riêng của chất A ở 11oC. Hỏi có thể xác định khối lượng riêng của chất A cỏ 150oC không?
c) Viết phương trình của ba phản ứng được dùng để điều chế khí A và ba phản ứng chỉ tính chất đặc trưng của khí A
I2O5 là một chất rắn tinh thể màu trắng, có khả năng định lượng với CO. Để xác định hàm lượng khí CO có trong một mẫu khí ta lấy 300 mL mẫu khí cho tác dụng hoàn toàn với một lượng dư I2O5 ở nhiệt độ cao. Lượng iodine sinh ra được chuẩn độ bằng dung dịch Na2S2O3 0,100M. Hãy xác định phần trăm về thể tích của CO trong hỗn hợp khí. Biết rằng thể tích Na2S2O3 cần dùng là 16,00 mL. Biết thể tích khí đo ở điều kiện tiêu chuẩn
1/ Để nhận biết ion sulfite, người ta cho vào một ống nghiệm 1-2 giọt dung dịch iodine, 3-4 giọt dung dịch A có chứa ion sulfite (1). Sau đó cho tiếp vào đó 2-3 giọt dung dịch HCl và vài giọt dung dịch BaCl2 thấy xuất hiện kết tủa B (2).
a) Nêu hiện tượng xảy ra trong các giai đoạn (1) và (2) của thí nghiệm và viết phương trình hóa học để minh họa.
b) Cho biết tại sao thí nghiệm nhận biết ion sulfite nêu trên thường được tiến hành trong môi trường acid hoặc môi trường trung hòa, không được tiến hành trong môi trường base?
2/ Trong công nghiệp, bromine được điều chế từ nước biển theo quy trình như sau: Cho một lượng dung dịch H2SO4 vào một lượng nước biển, tiếp theo sục khí chlorine vào dung dịch mới thu được (1), sau đó dùng không khí lôi cuốn hơi bromine vào dung dịch Na2CO3 tới bão hòa bromine (2). Cuối cùng cho H2SO4 vào dung dịch bão hòa bromine (3), thu hơi bromine rồi hóa lỏng. Hãy viết các phương trình hóa học chính xảy ra trong các quá trình (1), (2), (3)
1/ Nhận biết ion sulfite
a) Hiện tượng và phương trình hóa học:
-Giai đoạn (1):
-Hiện tượng: Khi nhỏ dung dịch iodine vào dung dịch chứa ion \(SO_3^{2-}\), màu vàng của dung dịch iodine sẽ bị mất màu.
Phương trình hóa học:\(SO_3^{2-}+I_2+H_2O-->SO_4^{2-}+2I^-+2H^+\)
+ Trong phản ứng này, ion sulfite bị oxy hóa thành ion sulfate, đồng thời iod bị khử thành ion iodide.
Giai đoạn (2):
Hiện tượng: Khi thêm dung dịch HCl và BaCl₂ vào, sẽ xuất hiện kết tủa trắng của bari sulfate (BaSO\(_4\)).
PTHH: \(Ba^{2+}+SO_4^{2-}---->BaSO_4\downarrow\left(trắng\right)\)
b) Lý do thí nghiệm nhận biết ion sulfite được tiến hành trong môi trường acid hoặc trung hòa:-Trong môi trường base, ion sulfite (SO32−\text{SO}_3^{2-}) có thể tồn tại dưới dạng ion hydrosulfite (HSO3−\text{HSO}_3^-) và phản ứng với các chất oxy hóa sẽ bị ảnh hưởng, làm giảm hiệu quả nhận biết. Đồng thời, phản ứng tạo kết tủa bari sulfate (BaSO4\text{BaSO}_4) cần môi trường acid hoặc trung hòa để xảy ra một cách hiệu quả. Nếu môi trường quá kiềm, có thể xảy ra sự hòa tan của kết tủa hoặc tạo ra các phức chất khác, làm khó nhận biết kết quả.1) Vì nước Javen là chất không ổn định, trong môi trường không khí dễ xảy ra phản ứng:
\(NaClO+CO_2+H_2O\rightarrow NaHCO_3+HClO\)
Trong đó HClO có tính tẩy màu.
2) Hiện tượng: xuất hiện dung dịch màu vàng nâu sau đó dung dịch bị mất màu.
Giải thích: Cl2 oxi hóa dung dịch NaBr tạo dung dịch Br2 màu vàng nâu, sục Cl2 liên tục trong thời gian dài tạo axit HClO có tính axit khử mạnh làm dung dịch mất màu.
PTHH:
\(Cl_2+2NaBr\rightarrow Br_2+2NaCl\)
\(Cl_2+H_2O\rightarrow HCl+HClO\)
3)
Giải thích: Vì sục Cl2 qua dung dịch trong thời gian dài tạo axit HClO có tính khử mạnh làm mất màu dung dịch vốn có.
PTHH:
\(Cl_2+2KI\rightarrow I_2+2KCl\)
\(Cl_2+H_2O\rightarrow HCl+HClO\)
4)
Khi cho ít dung dịch HCl vào nước Javen, hiện tượng: có khí vàng lục độc Cl2 thoát ra.
\(2HCl+NaClO\rightarrow NaCl+Cl_2+H_2O\)
Nếu thay axit HCl bằng HBr, hiện tượng sủi bọt khí vàng lục Cl2 thoát ra:
\(NaCl+HBr\rightarrow NaBr+HCl\\ 2HCl+NaClO\rightarrow NaCl+Cl_2+H_2O\)