a. Ta có: \(n_{CaO}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Theo PT: \(n_{CaCO_3}=n_{CaO}=0,2\left(mol\right)\)
Vậy số mol cần dùng để điều chế 11,2 gam CaO là 0,2 mol.
b. Ta có: \(n_{CaO}=\dfrac{7}{56}=0,125\left(mol\right)\)
Theo PT: \(n_{CaCO_3}=n_{CaO}=0,125\left(mol\right)\)
=> \(m_{CaCO_3}=0,125.100=12,5\left(g\right)\)
Vậy muốn điều chế 7 gam CaO cần có 12,5 gam CaCO3
c. Theo PT: \(n_{CO_2}=n_{CaCO_3}=3,5\left(mol\right)\)
=> \(V_{CO_2}=3,5.22,4=78,4\left(lít\right)\)
Vậy nếu có 3,5 mol CaCO3 tham gia phản ứng sẽ sinh ra 78,4 lít khí CO2
d. Ta có: \(n_{CO_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
Theo PT: \(n_{CaO}=n_{CaCO_3}=0,6\left(mol\right)\)
=> \(m_{CaO}=0,6.56=33,6\left(g\right)\)
\(m_{CaCO_3}=0,6.100=60\left(g\right)\)
Vậy nếu thu được 13,44 lít khí CO2 thì có 60 gam CaCO3 tham gia phản ứng và 33,6 gam CaO tạo thành






 GIÚP MIK VỚI Ạ!! MIK ĐANG CẦN GẤP
GIÚP MIK VỚI Ạ!! MIK ĐANG CẦN GẤP
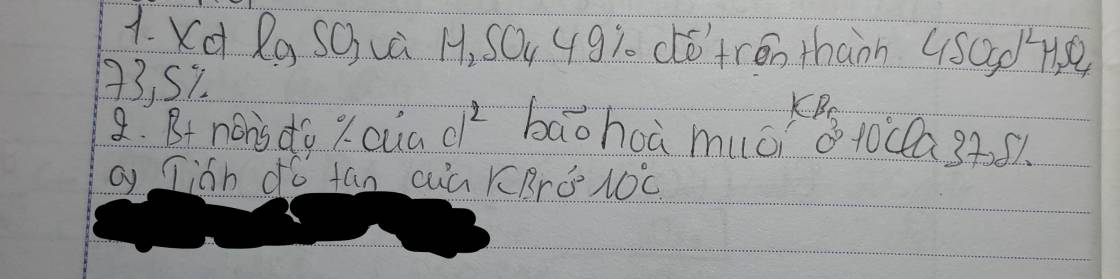 giải giúp mik vs ạ mik đang cần gấp!!!
giải giúp mik vs ạ mik đang cần gấp!!!







