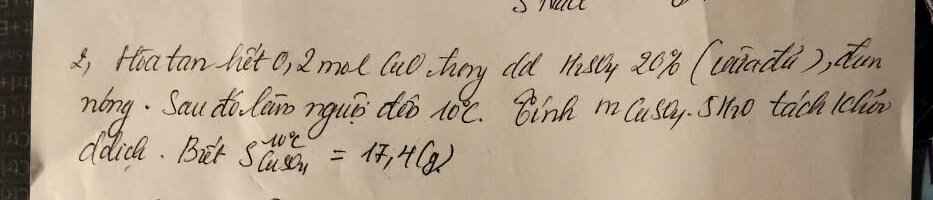\(CuO+H_2SO_4=CúSO_4+H_2O\)
Theo phương trình phản ứng ta có :
\(n_{H_2SO_4}=n_{CuO}=n_{CuSO_4}=n_{H_2O}=0,2\left(mol\right)\)
\(C\%\left(H_2SO_4\right)=\dfrac{m_{ct}}{m_{dd}\left(H_2SO_4\right)}.100\%\)
\(\Rightarrow m_{dd}\left(H_2SO_4\right)=\dfrac{m_{ct}}{C\%\left(H_2SO_4\right)}.100\%=\dfrac{0,2.98}{0,2}=98\left(g\right)\)
\(m_{CuSO_4}=0,2.160=32\left(g\right)\)
\(m\left(dd.sau.Pu\right)=0,2.18+98=114\left(g\right)\)
Ở \(10^{oC}\) , cứ \(100\left(g\right)H_2O\) hòa tan được \(17,4\left(g\right)CuSO_4\)
Đặt \(x\left(mol\right)CuSO_4.5H_2O\) tách ra thì dung dịch lúc này gồm :
\(32-160x\left(g\right)CuSO_4\) và \(82-90x\left(g\right)H_2O\)
\(\Rightarrow17,4.\left(82-90x\right)=100.\left(32-160x\right)\)
\(\Rightarrow x=0,12\left(mol\right)\)
\(m_{CuSO_4.5H_2O}=\left(160+90\right)x=30\left(g\right)\)