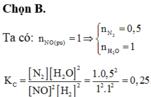Các câu hỏi tương tự
Xét phản ứng :
2
NO
+
2
H
2
⇄
N
2
+
2
H
2
O
(
k
)
xảy ra trong bình kín dung tích 2 lít, ở toC. Ban đầu mỗi chất t...
Đọc tiếp
Xét phản ứng : 2 NO + 2 H 2 ⇄ N 2 + 2 H 2 O ( k ) xảy ra trong bình kín dung tích 2 lít, ở toC. Ban đầu mỗi chất trong bình có 3 mol. Khi phản ứng đạt trạng thái cân bằng, số mol NO còn lại là 2 mol. Hằng số cân bằng Kc của phản ứng ở nhiệt độ đã cho là:
A. 0,0625.
B. 0,25.
C. 3,4.
D. 7,0.
Trong một bình kín dung tích 10 lít nung một hỗn hợp gồm 1 mol N2 và 4 mol H2 ở nhiệt độ t0C và áp suất P. Khi phản ứng đạt đến trong thái cân bằng thu được một hỗn hợp trong đó NH3 chiếm 25% thể tích. Xác định hằng số cân bằng KC của phản ứng: N2 + 3H2 2NH3 A. 25,6 B. 6,4 C. 12,8 D. 1,6
Đọc tiếp
Trong một bình kín dung tích 10 lít nung một hỗn hợp gồm 1 mol N2 và 4 mol H2 ở nhiệt độ t0C và áp suất P. Khi phản ứng đạt đến trong thái cân bằng thu được một hỗn hợp trong đó NH3 chiếm 25% thể tích. Xác định hằng số cân bằng KC của phản ứng: N2 + 3H2 <=> 2NH3
A. 25,6
B. 6,4
C. 12,8
D. 1,6
Cho cân bằng: Cho cân bằng:
C
(
r
)
+
C
O
2
(
k
)
↔
2
C
O
(
k
)
. Ở 550°C hằng số cân bằng Kc của phản ứng trên bằng 2.10-3. Người ta cho 0,2 mol C và 1 mol CO2 vào một bình kín dung tích 22,4 lít (không chứa không khí). Nâng dần nhiệt độ...
Đọc tiếp
Cho cân bằng: Cho cân bằng: C ( r ) + C O 2 ( k ) ↔ 2 C O ( k ) . Ở 550°C hằng số cân bằng Kc của phản ứng trên bằng 2.10-3. Người ta cho 0,2 mol C và 1 mol CO2 vào một bình kín dung tích 22,4 lít (không chứa không khí). Nâng dần nhiệt độ trong bình lên đến 550°C và giữ nhiệt độ đó để cho cân bằng được thiết lập. Số mol CO trong bình là:. Ở 550°C hằng số cân bằng Kc của phản ứng trên bằng 2.10-3. Người ta cho 0,2 mol C và 1 mol CO2 vào một bình kín dung tích 22,4 lít (không chứa không khí). Nâng dần nhiệt độ trong bình lên đến 550°C và giữ nhiệt độ đó để cho cân bằng được thiết lập. Số mol CO trong bình là:
A. 0,01 mol
B. 0,02 mol.
C. 0,1 mol
D. 0,2 mol.
Trộn 2 mol khí NO và 1 lượng chưa xác định khí O2 vào trong một bình kín có dung tích 1 lít ở 40oCđể xảy ra phản ứng 2NO + O2 ----- 2NO2Khi phản ứng đạt đến trạng thái cân bằng ta được hỗn hợp khí có 0,00156 mol O2 và 0,5 mol NO2.Hằng số cân bằng K ở nhiệt độ này có giá trị là:A. 4,,42 B. 40,1 C. 71,2 D. 214
Đọc tiếp
Trộn 2 mol khí NO và 1 lượng chưa xác định khí O2 vào trong một bình kín có dung tích 1 lít ở 40oC
để xảy ra phản ứng 2NO + O2 <-----> 2NO2
Khi phản ứng đạt đến trạng thái cân bằng ta được hỗn hợp khí có 0,00156 mol O2 và 0,5 mol NO2.
Hằng số cân bằng K ở nhiệt độ này có giá trị là:
A. 4,,42 B. 40,1 C. 71,2 D. 214
Cho cân bằng: C(r)+CO2(k)
⇌
2CO(k). Ở 5500C hằng số cân bằng KC của phản ứng trên bằng 2.10-3. Người ta cho 0,2 mol (C) và 1 mol CO2 vào một bình kín dung tích 22,4 lít (không chứa không khí). Nâng dần nhiệt độ trong bình lên đến 5500C và giữ nhiệt độ đó để cho cân bằng được thiết lập. Số mol CO trong bình là A. 0,01 B. 0,02 C. 0,1 D. 0,2
Đọc tiếp
Cho cân bằng: C(r)+CO2(k) ⇌ 2CO(k). Ở 5500C hằng số cân bằng KC của phản ứng trên bằng 2.10-3. Người ta cho 0,2 mol (C) và 1 mol CO2 vào một bình kín dung tích 22,4 lít (không chứa không khí). Nâng dần nhiệt độ trong bình lên đến 5500C và giữ nhiệt độ đó để cho cân bằng được thiết lập. Số mol CO trong bình là
A. 0,01
B. 0,02
C. 0,1
D. 0,2
Cho cân bằng: C(r) + CO2(k) ó 2CO(k). Ở 550oC , hằng số cân bằng KC của phản ứng trên bằng 2.10-3. Người ta cho 0,2 mol C và 1 mol CO2 vào bình kín dung tích 22,4 lít (không chứa không khí). Nâng dần nhiệt độ trong bình lên đến 550oC và giữ nhiệt độ đó để cho cân bằng được thiết lập. Số mol CO trong bình là A. 0,01 B. 0,02 C. 0,1 D. 0,2
Đọc tiếp
Cho cân bằng: C(r) + CO2(k) ó 2CO(k). Ở 550oC , hằng số cân bằng KC của phản ứng trên bằng 2.10-3. Người ta cho 0,2 mol C và 1 mol CO2 vào bình kín dung tích 22,4 lít (không chứa không khí). Nâng dần nhiệt độ trong bình lên đến 550oC và giữ nhiệt độ đó để cho cân bằng được thiết lập. Số mol CO trong bình là
A. 0,01
B. 0,02
C. 0,1
D. 0,2
Xét cân bằng trong bình kín có dung tích không đổi: X(khí) 2Y(khí)Ban đầu cho 1 mol khí X vào bình, khi đạt đến trạng thái cân bằng thì thấy: Tại thời điểm ở 350C trong bình có 0,730 mol X; Tại thời điểm ở 450C trong bình có 0,623 mol X. Có các phát biểu sau về cân bằng trên: 1. Phản ứng thuận là phản ứng thu nhiệt.2. Khi tăng áp suất, cân bằng chuyển dịch theo chiều nghịch.3. Thêm tiếp Y vào hỗn hợp cân bằng thì làm cho cân bằng chuyển dịch theo chiều nghịch.4. Thêm xúc tác thích hợp vào hỗn h...
Đọc tiếp
Xét cân bằng trong bình kín có dung tích không đổi: X(khí) <=> 2Y(khí)
Ban đầu cho 1 mol khí X vào bình, khi đạt đến trạng thái cân bằng thì thấy: Tại thời điểm ở 350C trong bình có 0,730 mol X; Tại thời điểm ở 450C trong bình có 0,623 mol X. Có các phát biểu sau về cân bằng trên:
1. Phản ứng thuận là phản ứng thu nhiệt.
2. Khi tăng áp suất, cân bằng chuyển dịch theo chiều nghịch.
3. Thêm tiếp Y vào hỗn hợp cân bằng thì làm cho cân bằng chuyển dịch theo chiều nghịch.
4. Thêm xúc tác thích hợp vào hỗn hợp cân bằng thì cân bằng vẫn không chuyển dịch.
Trong các phát biểu trên, số phát biểu đúng là
A. 2.
B. 1.
C. 3.
D. 4.
Một bình kín có thể tích là 0,5 lit chứa 0,5 mol H2 và 0,5 molN2 , ở nhiệt độ toC . Khi ở trạng tháu cân bằng có 0,2 mol NH3 tạo thành. Hằng số cân bằng Kc của phản ứng tổng hợp NH3 là A. 1,278 B. 3,125 C. 6,750 D. 4,125
Đọc tiếp
Một bình kín có thể tích là 0,5 lit chứa 0,5 mol H2 và 0,5 molN2 , ở nhiệt độ toC . Khi ở trạng tháu cân bằng có 0,2 mol NH3 tạo thành. Hằng số cân bằng Kc của phản ứng tổng hợp NH3 là
A. 1,278
B. 3,125
C. 6,750
D. 4,125
Cân bằng của phản ứng: N2 + O2
→
2NO được thực hiện ở t°C có hằng số cân bằng là 40. Biết rằng nồng độ ban đầu của N2 và O2 đều bằng 0,01. Nồng độ của O2 ở trạng thái cân bằng là: A. 0,0015. B. 0,0025 C. 0,0035 D. 0,0075.
Đọc tiếp
Cân bằng của phản ứng: N2 + O2 → 2NO được thực hiện ở t°C có hằng số cân bằng là 40. Biết rằng nồng độ ban đầu của N2 và O2 đều bằng 0,01. Nồng độ của O2 ở trạng thái cân bằng là:
A. 0,0015.
B. 0,0025
C. 0,0035
D. 0,0075.