Các câu hỏi tương tự
Cho các phát biểu sau: (1) Điều chế oxi trong phòng thí nghiệm bằng các nhiệt phân KMnO4 (rắn), KClO3 (rắn), … (2) Chưng cất phân đoạn không khí lỏng là phương pháp duy nhất điều chế oxi trong công nghiệp (3) Khí ozon không màu, không mùi, tan nhiều trong nước (4) Ozon có tính oxi hóa rất mạnh và mạnh hơn cả oxi (5) Ozon oxi hóa hầu hết các kim loại kể cả Au, Pt (6) Ở điều kiện bình thường, oxi và ozon có thể oxi hóa bạc thành bạc oxit Số phát biểu đúng là: A.2 B.1 ...
Đọc tiếp
Cho các phát biểu sau:
(1) Điều chế oxi trong phòng thí nghiệm bằng các nhiệt phân KMnO4 (rắn), KClO3 (rắn), …
(2) Chưng cất phân đoạn không khí lỏng là phương pháp duy nhất điều chế oxi trong công nghiệp
(3) Khí ozon không màu, không mùi, tan nhiều trong nước
(4) Ozon có tính oxi hóa rất mạnh và mạnh hơn cả oxi
(5) Ozon oxi hóa hầu hết các kim loại kể cả Au, Pt
(6) Ở điều kiện bình thường, oxi và ozon có thể oxi hóa bạc thành bạc oxit
Số phát biểu đúng là:
A.2
B.1
C.3
D.4
Cho các phát biểu sau: (1) Điều chế oxi trong phòng thí nghiệm bằng các nhiệt phân KMnO4 (rắn), KClO3 (rắn),... (2) Chưng cất phân đoạn không khí lỏng là phương pháp duy nhất điều chế oxi trong công nghiệp. (3) Khí ozon không màu, không mùi, tan nhiều trong nước. (4) Ozon có tính oxi hoá rất mạnh và mạnh hơn cả ozon. (5) Ozon oxi hoá hầu hết các kim loại kể cả Au, Pt. (6) Ở điều kiện bình thường, oxi và ozon có thể oxi hoá bạc thành bạc oxit. Số phát biểu đúng là: A. 2. B. 1. C. 3. D. 4
Đọc tiếp
Cho các phát biểu sau:
(1) Điều chế oxi trong phòng thí nghiệm bằng các nhiệt phân KMnO4 (rắn), KClO3 (rắn),...
(2) Chưng cất phân đoạn không khí lỏng là phương pháp duy nhất điều chế oxi trong công nghiệp.
(3) Khí ozon không màu, không mùi, tan nhiều trong nước.
(4) Ozon có tính oxi hoá rất mạnh và mạnh hơn cả ozon.
(5) Ozon oxi hoá hầu hết các kim loại kể cả Au, Pt.
(6) Ở điều kiện bình thường, oxi và ozon có thể oxi hoá bạc thành bạc oxit.
Số phát biểu đúng là:
A. 2.
B. 1.
C. 3.
D. 4
Trong phòng thí nghiệm khí oxi có thể được điều chế bằng cách nhiệt phân muối KClO3 có MnO2 làm xúc tác và có thể được thu bằng cách đẩy nước hay đẩy không khí. Trong các hình vẽ cho dưới đây, hình vẽ nào mô tả điều chế oxi đúng cách: A. 2 và 3 B. 3 và 4 C. 1 và 2 D. 1 và 3
Đọc tiếp
Trong phòng thí nghiệm khí oxi có thể được điều chế bằng cách nhiệt phân muối KClO3 có MnO2 làm xúc tác và có thể được thu bằng cách đẩy nước hay đẩy không khí. Trong các hình vẽ cho dưới đây, hình vẽ nào mô tả điều chế oxi đúng cách:
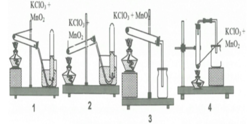
A. 2 và 3
B. 3 và 4
C. 1 và 2
D. 1 và 3
Có các phát biểu sau: (a) Trong công nghiệp N2 được điều chế bằng cách chưng cất phân đoạn không khí lỏng. (b) Nhiệt phân NH4NO3 tạo thành NH3 và HNO3. (c) Chất lượng phân kali được đánh giá thông qua phần trăm theo khối lượng của kali. (d) Tính oxi hóa mạnh của HNO3 là do ion H+ gây ra. (e) CO, N2O, NO là oxit axit. (f) Trong khí than ướt và khí than khô đều có chứa CO. Số phát biểu sai là A. 4 B. 2 C. 3 D. 5
Đọc tiếp
Có các phát biểu sau:
(a) Trong công nghiệp N2 được điều chế bằng cách chưng cất phân đoạn không khí lỏng.
(b) Nhiệt phân NH4NO3 tạo thành NH3 và HNO3.
(c) Chất lượng phân kali được đánh giá thông qua phần trăm theo khối lượng của kali.
(d) Tính oxi hóa mạnh của HNO3 là do ion H+ gây ra.
(e) CO, N2O, NO là oxit axit.
(f) Trong khí than ướt và khí than khô đều có chứa CO.
Số phát biểu sai là
A. 4
B. 2
C. 3
D. 5
Trong các phản ứng sau: Nhiệt phân KClO3 có xúc tác MnO2; nhiệt phân CaCO3; nhiệt phân KMnO4; nhiệt phân NH4NO3; nhiệt phân AgNO3, có bao nhiêu phản ứng là phản ứng nội oxi hóa khử? A. 2 B. 3 C. 4 D. 5
Đọc tiếp
Trong các phản ứng sau: Nhiệt phân KClO3 có xúc tác MnO2; nhiệt phân CaCO3; nhiệt phân KMnO4; nhiệt phân NH4NO3; nhiệt phân AgNO3, có bao nhiêu phản ứng là phản ứng nội oxi hóa khử?
A. 2
B. 3
C. 4
D. 5
Khi nhiệt phân 100 gam mỗi chất sau: KClO3 (xúc tác MnO2) KMnO4, KNO3 và AgNO3. Chất tạo ra lượng khí oxi lớn nhất là A. KNO3 B. KClO3 C. AgNO3 D. KMnO4
Đọc tiếp
Khi nhiệt phân 100 gam mỗi chất sau: KClO3 (xúc tác MnO2) KMnO4, KNO3 và AgNO3. Chất tạo ra lượng khí oxi lớn nhất là
A. KNO3
B. KClO3
C. AgNO3
D. KMnO4
Cho các thí nghiệm sau: (1) Nung hỗn hợp NaNO2 và NH4Cl. (2) Điện phân dung dịch CuSO4 (điện cực trơ, graphit). (3) Dẫn khí NH3 qua CuO nung nóng. (4) Nhiệt phân Ca(NO3)2. (5) Cho khí CO2 tác dụng với H2O có ánh sáng, clorofin. (6) H2O2 tác dụng với dung dịch KMnO4 trong H2SO4. (7) Cho khí O3 tác dụng với dung dịch KI. (8) Điện phân NaOH nóng chảy. (9) Dẫn hơi nước qua than nóng đỏ. (10) Nhiệt phân KMnO4. (11) Thêm MnO2 vào muối KClO3 đun nóng. (12) Nhiệt phân muối NH4HCO3. (13) Hấp thụ Na vào n...
Đọc tiếp
Cho các thí nghiệm sau:
(1) Nung hỗn hợp NaNO2 và NH4Cl.
(2) Điện phân dung dịch CuSO4 (điện cực trơ, graphit).
(3) Dẫn khí NH3 qua CuO nung nóng.
(4) Nhiệt phân Ca(NO3)2.
(5) Cho khí CO2 tác dụng với H2O có ánh sáng, clorofin.
(6) H2O2 tác dụng với dung dịch KMnO4 trong H2SO4.
(7) Cho khí O3 tác dụng với dung dịch KI.
(8) Điện phân NaOH nóng chảy.
(9) Dẫn hơi nước qua than nóng đỏ.
(10) Nhiệt phân KMnO4.
(11) Thêm MnO2 vào muối KClO3 đun nóng.
(12) Nhiệt phân muối NH4HCO3.
(13) Hấp thụ Na vào nước.
(14) Điện phân dung dịch HCl.
(15) Cho MnO2 tác dụng với HCl đặc.
Số thí nghiệm thu được khí oxi là
A. 8.
B. 9.
C. 10.
D. 11.
Cho các phát biểu sau: (1) Nitơ lỏng được dùng để bảo quản máu và các mẫu vật (2) Trong tự nhiên, nitơ chỉ tồn tại ở dạng đơn chất (3) Trong công nghiệp,, nitơ được sản xuất bằng phương pháp chưng cất phân đoạn không khí lỏng (4) Trong phòng thí nghiệm, nitơ được điều chế bằng phản ứng nhiệt phân NH4NO3 (5) Trong phân tử amoniac, nitơ liên kết với Hiđro bằng liên kết cộng hóa trị có cực (6) Amoniac là chất khí không màu, mùi khai và xốc, nhẹ hơn không khí Số phát biểu đúng là A. 6 ...
Đọc tiếp
Cho các phát biểu sau:
(1) Nitơ lỏng được dùng để bảo quản máu và các mẫu vật
(2) Trong tự nhiên, nitơ chỉ tồn tại ở dạng đơn chất
(3) Trong công nghiệp,, nitơ được sản xuất bằng phương pháp chưng cất phân đoạn không khí lỏng
(4) Trong phòng thí nghiệm, nitơ được điều chế bằng phản ứng nhiệt phân NH4NO3
(5) Trong phân tử amoniac, nitơ liên kết với Hiđro bằng liên kết cộng hóa trị có cực
(6) Amoniac là chất khí không màu, mùi khai và xốc, nhẹ hơn không khí
Số phát biểu đúng là
A. 6
B. 3
C. 5
D. 4
Trong công nghiệp người ta thường điều chế kim loại K bằng cách?A. Điện phân dung dịch KCl không có màng ngăn. B. Điện phân dung dịch KCl có màng ngăn. C. Dùng CO khử K+ trong K2O ở nhiệt độ cao. D. Điện phân KCl nóng chảy. A. Điện phân dung dịch KCl không có màng ngăn. B. Điện phân dung dịch KCl có màng ngăn. C. Dùng CO khử K+ trong K2O ở nhiệt độ cao. D. Điện phân KCl nóng chảy.
Đọc tiếp
Trong công nghiệp người ta thường điều chế kim loại K bằng cách?A. Điện phân dung dịch KCl không có màng ngăn. B. Điện phân dung dịch KCl có màng ngăn.
C. Dùng CO khử K+ trong K2O ở nhiệt độ cao. D. Điện phân KCl nóng chảy.
A. Điện phân dung dịch KCl không có màng ngăn.
B. Điện phân dung dịch KCl có màng ngăn.
C. Dùng CO khử K+ trong K2O ở nhiệt độ cao.
D. Điện phân KCl nóng chảy.
Để điều chế oxi trong phòng thí nghiệm, người ta nhiệt phân muối kaliclorat (xt: MnO2). Công thức phân tử của muối kalicorat là A. K2Cr2O4. B. KClO3. C. K2Cr2O7. D. KClO4.
Đọc tiếp
Để điều chế oxi trong phòng thí nghiệm, người ta nhiệt phân muối kaliclorat (xt: MnO2). Công thức phân tử của muối kalicorat là
A. K2Cr2O4.
B. KClO3.
C. K2Cr2O7.
D. KClO4.



