Các phương trình phản ứng:
Fe + 2FeCl3 → 3FeCl2
Fe + AlCl3 → không xảy ra.
Fe + CuSO4 → FeSO4 + Cu
Fe + Pb(NO3)2 → Fe(NO3)2 +Pb
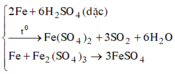
Các thí nghiệm tạo ra Fe(II) là nhúng lá sắt dư vào các dung dịch FeCl3, CuSO4, Pb(NO3)2, H2SO4 đặc nóng.
Đáp án C.
Các phương trình phản ứng:
Fe + 2FeCl3 → 3FeCl2
Fe + AlCl3 → không xảy ra.
Fe + CuSO4 → FeSO4 + Cu
Fe + Pb(NO3)2 → Fe(NO3)2 +Pb
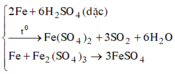
Các thí nghiệm tạo ra Fe(II) là nhúng lá sắt dư vào các dung dịch FeCl3, CuSO4, Pb(NO3)2, H2SO4 đặc nóng.
Đáp án C.
Nhúng một lá sắt nhỏ vào dung dịch chứa một trong những chất sau: FeCl3, AlCl3, CuSO4, Pb(NO3)2, NaCl, HCl, HNO3 dư, H2SO4 (đặc nóng, dư), NH4NO3. Số trường hợp phản ứng tạo muối sắt (II) là
A. 3
B. 4
C. 5
D. 6
Nhúng một lá sắt nhỏ vào dd chứa một trong những chất sau: FeCl3, AlCl3, CuSO4, Pb(NO3)2, NaCl, HNO3 (loãng, dư), H2SO4 (đặc, nóng, dư), NH4NO3, AgNO3 thiếu. Số trường hợp phản ứng tạo muối Fe(II) là
A. 3
B. 4
C. 5.
D. 6.
Cho một lá sắt nhỏ vào lượng dư các dung dịch sau: FeCl3, AlCl3, CuSO4, Pb(NO3)2, NaCl, HCl, HNO3, H2SO4 loãng, NH4NO3. Tổng số trường hợp tạo ra muối sắt (II) là:
A. 7
B. 6
C. 5
D. 4
Nhúng một lá sắt nhỏ lần lượt vào dung dịch chứa một trong những chất sau: AgNO3 dư, FeCl3, AlCl3, CuSO4, HCl, HNO3 dư. Số trường hợp phản ứng tạo muối Fe(II) là
A, 3
B. 4
C. 5
D. 2
Tiến hành các thí nghiệm sau:
- TN 1: Cho hơi nước đi qua ống đựng bột sắt nung nóng.
- TN 2: Cho đinh sắt nguyên chất vào dung dịch H2SO4 loãng có nhỏ thêm vài giọt dung dịch CuSO4.
- TN 3: Cho từng giọt dung dịch Fe(NO3)2 vào dung dịch AgNO3.
- TN 4: Để miếng gang (hợp kim của sắt với cacbon) trong không khí ẩm một thời gian.
- TN 5: Nhúng lá kẽm nguyên chất vào dung dịch CuSO4.
Số trường hợp xảy ra ăn mòn điện hoá học là
A. 1
B. 2.
C. 4.
D. 3.
Tiến hành các thí nghiệm sau:
1: TN 1: Cho hơi nước đi qua ống đựng bột sắt nung nóng.
2: TN 2: Cho đinh sắt nguyên chất vào dung dịch H2SO4 loãng có nhỏ thêm vài giọt dung dịch CuSO4.
3: TN 3: Cho từng giọt dung dịch Fe(NO3)2 vào dung dịch AgNO3
4: TN 4: Để miếng gang (hợp kim của sắt với cacbon) trong không khí ẩm một thời gian.
5: TN 5: Nhúng lá kẽm nguyên chất vào dung dịch CuSO4.
Số trường hợp xảy ra ăn mòn điện hoá học là:
A. 3
B. 4
C. 1
D. 2
Tiến hành các thí nghiệm sau:
1: TN 1: Cho hơi nước đi qua ống đựng bột sắt nung nóng.
2: TN 2: Cho đinh sắt nguyên chất vào dung dịch H2SO4 loãng có nhỏ thêm vài giọt dung dịch CuSO4.
3: TN 3: Cho từng giọt dung dịch Fe(NO3)2 vào dung dịch AgNO3
4: TN 4: Để miếng gang (hợp kim của sắt với cacbon) trong không khí ẩm một thời gian.
5: TN 5: Nhúng lá kẽm nguyên chất vào dung dịch CuSO4.
Số trường hợp xảy ra ăn mòn điện hoá học là:
A. 3
B. 4
C. 1
D. 2
Thực hiện các thí nghiệm sau:
(1) Đốt dây kim loại Fe dư trong khí Cl2.
(2) Cho Fe3O4 vào dung dịch HNO3 (loãng, dư).
(3) Đốt nóng hỗn hợp Fe và S (trong chân không).
(4) Cho kim loại Fe vào lượng dư dung dịch HCl.
(5) Nhúng thanh sắt vào dung dịch HNO3 đặc nguội, rồi lấy ra cho vào dung dịch HCl loãng.
(6). Cho Fe (dư) vào dung dịch hỗn hợp chứa HCl và KNO3.
(7). Cho bột sắt vào dung dịch AgNO3 (dư).
(8). Cho bột sắt vào dung dịch CuCl2 (dư).
Sau khi các phản ứng xảy ra hoàn toàn, có bao nhiêu thí nghiệm thu được muối sắt(II)?
A. 5
B. 4
C. 3
D. 6
Thực hiện các thí nghiệm sau:
(1). Đốt dây kim loại Fe dư trong khí Cl2.
(2). Cho Fe3O4 vào dung dịch HNO3 (loãng, dư).
(3). Đốt nóng hỗn hợp Fe và S (trong chân không).
(4). Cho kim loại Fe vào lượng dư dung dịch HCl.
(5). Nhúng thanh sắt vào dung dịch HNO3 đặc nguội, rồi lấy ra cho vào dung dịch HCl loãng.
(6). Cho Fe (dư) vào dung dịch hỗn hợp chứa HCl và KNO3.
(7). Cho bột sắt vào dung dịch AgNO3 (dư).
(8). Cho bột sắt vào dung dịch CuCl2 (dư).
Sau khi các phản ứng xảy ra hoàn toàn, có bao nhiêu thí nghiệm thu được muối sắt (II)?
A. 5.
B. 4.
C. 3.
D. 6.