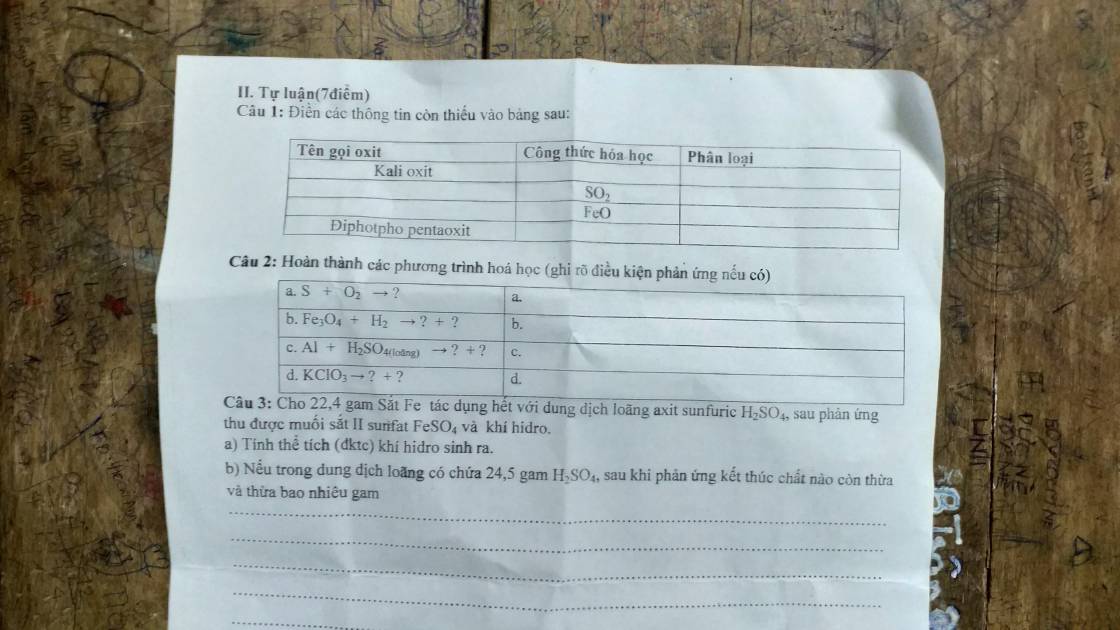
a) $2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2$
b)
n H2 = 6,72/22,4 = 0,3(mol)
n Al = 2/3 n H2 = 0,2(mol)
m Al = 0,2.27 = 5,4(gam)
m Cu = 10 - 5,4 = 4,6(gam)
c) n H2SO4 = n H2 = 0,3(mol)
m dd H2SO4 = 0,3.98/20% = 147 gam
Bài 1 :
\(n_{H_2}=\dfrac{5.6}{22.4}=0.25\left(mol\right)\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(0.25.................................0.25\)
\(m_{Fe}=0.25\cdot56=14\left(g\right)\)
\(m_{Ag}=16.16-14=2.16\left(g\right)\)
a. \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
b. \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo PTHH \(n_{Al}=\dfrac{2}{3}n_{H_2}=0,2\left(mol\right)\)
\(m_{Al}=0,2.27=5,4\left(g\right)\)
\(m_{Cu}=10-5,4=4,6\left(g\right)\)
c. Theo PTHH: \(n_{H_2SO_4}=n_{H_2}=0,3\left(mol\right)\)
\(m_{H_2SO_4}=0,3.98=29,4\left(g\right)\)
\(m_{ddH_2SO_4}=\dfrac{29,4.100}{20}=147\left(g\right)\)