bài 3a) NaOH : natri hiđroxit bazo
H2SO4 : axit sunfuric axit
HCl : axit clorua axit
KOH: kali hiđroxit bazo
đánh dấu và lấy mẫu thử
nhỏ lần lượt dung dịch vào quỳ tím thấy quỳ tím chuyển xanh là H2SO4
c)
đánh số thứ tự và lấy mẫu thử
nhỏ lần lượt dung dịch vào quỳ tím thấy quỳ tím chuyển xanh là HCl
nhỏ lần lượt dung dịch vào quỳ tím thấy quỳ tím chuyển đỏ là KOH
nhỏ lần lượt dung dịch vào quỳ tím thấy quỳ tím chuyển đỏ là KOH
bài 4
Fe2O3 + 3H2 -to-> 2Fe + 3H2O
0,1 0,3 0,2
nH2 = 11,2/22,4=0,5mol
nFe2O3= 16/160=0,1
ta thấy nFe2O3/1 = 0,1 < nH2/3=0,5/3
=> Fe2O3 hết H2 dư
=> nFe= 0,2 mol => mFe= 0,2 *56=11,2 g
c) sau phản ứng H2 dư => nH2 dư = nH2 đầu - nH2 p/ư
= 0,5- 0,3=0,2mol
=> vH2 = 0,2 * 22,4=4,48 l
Bài 3 :
a) NaOH --> Natri hidroxit --> bazo
H2SO4 --> Axit sunfuric --> axit
HCl --> Axit clohidric --> axit
KOH --> Kali hidroxit --> bazo
b)
- Đánh .... tự lọ NaOH là 1, H2SO4 là 2
- Nhỏ lần lượt 2 giọt dung dịch ở 2 lọ là lọ 1 và 2 vào giấy quỳ tím
- Nếu 1 dung dịch ... ban đầu là : NaOH (bazo)
c)
- Đánh số thứ tự lọ KOH là 1, HCl là 2
- Nhỏ lần lượt 2 giọt dung dịch ở 2 lọ là lọ 1 và 2 vào giấy quỳ tím
- Nếu 1 dung dịch ... chuyển màu xanh ,...ban đầu là : KOH (bazo)
- Nếu 1 dung dịch ... chuyển màu đỏ ,...ban đầu là : HCl (axit)
Bài 4 :
a) PTHH : \(3H_2+Fe_2O_3-->2Fe+3H_2O\) (1)
b) \(n_{H_2}=\dfrac{V}{22.4}=\dfrac{11.2}{22.4}=0.5\left(mol\right)\)
Từ (1) => \(\dfrac{2}{3}n_{H_2}=n_{Fe}\approx0.3\left(mol\right)\)
=> \(m_{Fe}=n.M\approx0.3x56\approx18.6\left(g\right)\)
c) Có \(n_{H_2}=0.5\left(mol\right)\)
\(n_{Fe_2O_3}=\dfrac{m}{M}=\dfrac{16}{\left(56.2+16.3\right)}=0.1\left(mol\right)\)
Có : \(n_{H_2}>n_{Fe_2O_3}\)
=> H2 dư , Fe2O3 hết
=> \(n_{H_2\left(dư\right)}=n_{H_2}-n_{Fe_2O_3}=0.5-0.1=0.4\left(mol\right)\)
=> \(V_{H_2\left(dư\right)}=n.22.4=0.4x22.4=8.96\left(l\right)\)

 làm hộ mình câu 3 và 4 với
làm hộ mình câu 3 và 4 với














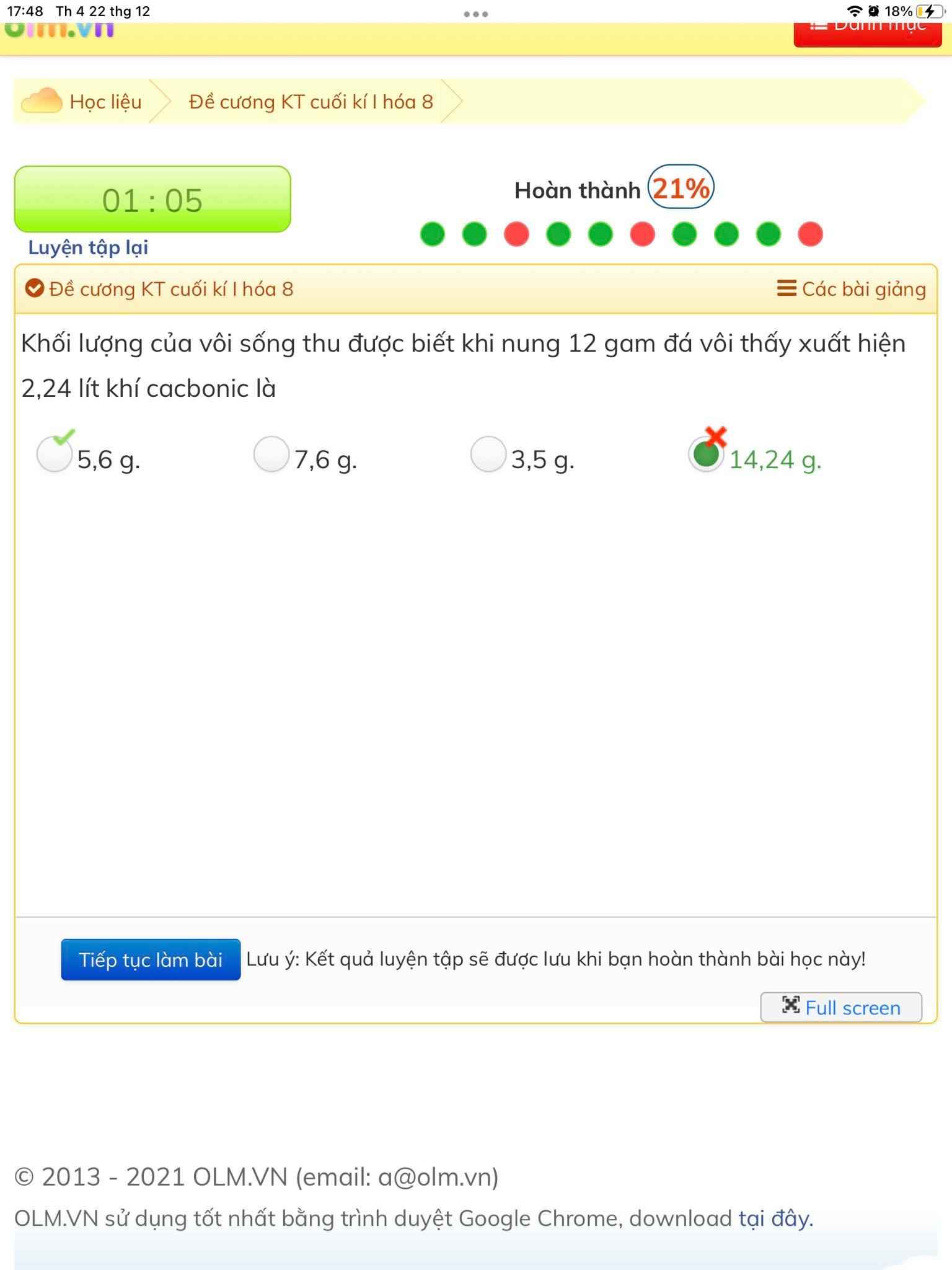 các bạn giải thích các bước làm hộ mình với
các bạn giải thích các bước làm hộ mình với 


 Giúp mình giải các câu hỏi trên trừ 2 câu khoanh tròn vì mình đã làm r giúp mik với :3 cảm ơn nhiều ( lưu ý : giải chi tiết vì mình đang bắt đầu học )
Giúp mình giải các câu hỏi trên trừ 2 câu khoanh tròn vì mình đã làm r giúp mik với :3 cảm ơn nhiều ( lưu ý : giải chi tiết vì mình đang bắt đầu học )


