Hỗn hợp A gồm rượu etylic và 2 axit hữu cơ kế tiếp nhau có dạng CnH2n+1COOH. Chia hỗn hợp A làm hai phần bằng nhau:
- Phần 1: Cho tác dụng hết với Na thì thu được 3,92 lít khí H2 (đktc).
- Phần 2: Đem đốt cháy hoàn toàn, sau đó dẫn toàn bộ sản phẩm cháy lần lượt qua bình 1 đựng H2SO4 đặc rồi đến bình 2 đựng dung dịch Ba(OH)2 dư, thấy khối lượng bình 1 tăng thêm 17,1 gam và ở bình 2 xuất hiện 147,75 gam kết tủa.
1. Xác định công thức của 2 axit hữu cơ có trong hỗn hợp A?
2. Tính thành phần phần trăm về khối lượng mỗi chất có trong hỗn hợp A?
Cho biết: H = 1; Li = 7; C = 12; N = 14; O = 16; Mg = 24; Cl = 35,5; Ca = 40; Fe = 56; Cu = 64 ; Rb = 85; Ba = 137
1.Gọi số mol của C2H5OH và hỗn hợp CnH2n+1COOH là a và b (mol)
Phần 1: nH2 = 3,92 : 22,4 = 0,175 (mol)
2C2H5OH + 2Na → 2C2H5ONa + H2↑
a → 0,5a (mol)
2CnH2n+1COOH + 2Na → 2CnH2n+1COONa + H2↑
b → 0,5b (mol)
Phần 2:
C2H6O + O2 → 2CO2 + 3H2O
a → 2a → 3a (mol)
Cn+1H2n+2O2 + (3n+1)/2O2 → ( n+1) CO2 + ( n+1) H2O
b → (n+1)b → (n+1)b (mol)
Sản phẩm cháy gồm CO2 và H2O
Khi cho qua bình đựng H2SO4 đặc thì H2O bị hấp thụ , khi cho qua bình 2 đựng Ca(OH)2 dư thì CO2 bị hấp thụ
=> mb1 tăng = mH2O = 17,1 (g) => nH2O = 17,1 : 18 = 0,95 (mol)
CO2 + Ba(OH)2 dư → BaCO3↓ + H2O
nBaCO3 = 147,75 : 197 = 0,75 (mol)
Ta có:
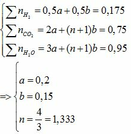
Vì 2 axit hữu cơ là đồng đẳng kế tiếp => 1< n = 4/3 < 2
Vậy CTCT của 2 axit hữu cơ là CH3COOH và C2H5COOH
2. Gọi số mol của CH3COOH và C2H5COOH lần lượt là x và y (mol)






