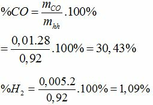Đốt cháy hoàn toàn 0,92 gam hỗn hợp X gồm C2H4, H2, C3H6, CO, C4H8 bằng O2 vừa đủ rồi cho toàn bộ sản phẩm cháy vào bình đựng 2 lít dung dịch Ca(OH)2 0,02 M thấy xuất hiện m1gam kết tủa. Lọc bỏ kết tủa, thu được dung dịch Y có khối lượng tăng 0,82 gam so với dung dịch Ca(OH)2 ban đầu. Thêm từ từ dung dịch Ba(OH)2 vào dung dịch Y đến khi kết tủa hết các ion kim loại, thấy có m2 gam kết tủa. Biết m1 + m2 = 6,955, tính thành phần phần trăm theo khối lượng của CO và H2 có trong hỗn hợp X.

C2H4, C3H6, C4H8 cùng là anken nên có công thức chung là CnH2n
2CO + O2 → 2CO2↑ (1)
x → x (mol)
2H2 + O2 → 2H2O (2)
y → y (mol)
CnH2n + O2 → nCO2 + 2nH2O (3)
Sản phẩm cháy thu được gồm có CO2 và H2O.
Khi hấp thụ vào dd Ca(OH)2: 0,04 mol thu được dung dịch Y, thêm từ từ Ba(OH)2 vào dung dịch Y thu được kết tủa của các ion kim loại => CO2 phản ứng với Ca(OH)2 theo phương trình:
CO2 + Ca(OH)2 → CaCO3↓ + H2O (4)
CO2 + Ca(OH)2 → Ca(HCO3)2 + H2O (5)
Dd Y chứa Ca(HCO3)2
BaCl2 + Ca(HCO3)2 → CaCO3↓ + BaCO3↓ + H2O (6)
m1 = mCaCO3(4)
m2 = mCaCO3(5) + mBaCO3
=> m1 + m2 = ∑ mCaCO3↓ + mBaCO3 = 6,955 (g) (*)
BTNT Ca: => ∑nCaCO3↓ = ∑ nCa(OH)2 (4+5) = 0,04 (mol)
Từ (*)

=> nCaCO3(6) = nBaCO3 = 0,015 (mol)
=> nCaCO3(4) = ∑nCa(OH)2 – nBaCO3 = 0,04 – 0,015 = 0,025 (mol)
BTNT C => ∑ nCO2 = ∑ nCaCO3 + nBaCO3 = 0,04 + 0,015 = 0,055 (mol)
Khối lượng dd Y tăng 0,82 gam so với dd Ca(OH)2 ban đầu
=> mCO2 + mH2O – mCaCO3(4) = 0,82
=> mH2O = 0,82 + 0,025.100 – 0,055.44 = 0,9 (g)
=> nH2O = 0,9 : 18 = 0,05 (mol)
BTKL ta có: mhhX + mO2 = mCO2 + mH2O
=> mO2 = 0,055.44 + 0,9 – 0,92 = 2,4 (g) => nO2 = 0,075 (mol)
BTNT O: nO( trong CO) + 2nO2 = 2nCO2 + nH2O
=> nO( trong CO) = 2.0,055 + 0,05 – 0,075.2 = 0,01 (mol) => nCO = 0,01 (mol)
Từ PTHH (1), (2), (3) ta thấy khi đốt cháy CnH2n luôn cho nH2O = nCO2 => sự chênh lệch mol CO2 và mol H2O là do đốt cháy CO và H2
=> nCO2 – nH2O = x – y = 0,055 – 0,05 = 0,005 (mol)
Mặt khác: nCO – nH2 = x – y = 0,005 (mol)
=> nH2 = nCO – 0,005= 0,01 – 0,005 = 0,055 (mol)