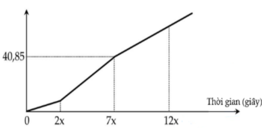
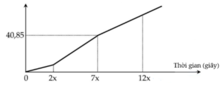
Hòa tan hoàn toàn hh X gồm ba chất FeCl3, FeCl2, CuCl2 trong nước thu được dung dịch Y. Điện phân dung dịch Y bằng dòng điện một chiều với điện cực trơ. Đồ thị biểu diễn khối lượng dung dịch giảm theo thời gian như sau: Nếu cho NaOH dư vào dung dịch đã điện phân được 10x giây thì thu được 31,5 gam kết tủa. Nếu điện phân dung dịch Y trong thời gian 12x giây giây sau đó cho AgNO3 dư vào dung dịch sau điện phân thì khối lượng kết tủa thu được gần nhất với:
A. 100
B. 99
C. 180
D. 179
Đáp án B
Thứ tự điện phân bên catot: Fe3+; Cu2+; Fe2+ và bên anot có Cl- bị điện phân.
Nhìn vào đồ thị ta thấy có 3 đoạn dung dịch thay đổi.
+ Đoạn 1: bên catot chỉ có Fe3+ điện phân, anot có Cl-.
+ Đoạn 2: bên catot có Fe3+ và Cu2+, anot có Cl-.
+ Đoạn 3: bên catot có cả 3 ion điện phân, anot có Cl-.
Tại 2x (s):
Fe3+ + 1e → Fe2+ 2Cl- → Cl2 + 2e.
Gọi n(Cl-) = 2a → n(e) = n(Fe3+ bđ) = 2a mol.
→ Tại 7x (s) thì n(e) = 7a (mol
Fe3+ + 1e → Fe2+. 2Cl- → Cl2 + 2e.
2a→ 2a → 2a 7a ← 3,5a ← 7a
Cu2+ + 2e → Cu
→ n(e trong đp Cu2+) = 5a → n(Cu2+ bđ) = 2,5a (mol)
→ m(dd giảm) = m(Cu) + m(Cl2) = 64. 2,5a + 71. 3,5a = 40,85 → a = 0,1 mol
→ Tại 10x (s) thì n(e) = 1 mol.
Fe3+ + 1e → Fe2+. 2Cl- → Cl2 + 2e.
0,2→ 0,2 → 0,2 1 ← 0,5 ← 1
Cu2+ + 2e → Cu
0,25 → 0,5→ 0,25
Fe2+ + 2e → Fe.
→ n(e trong đp Fe2+) = 0,3 mol → n(Fe2+ đp) = 0,15 mol
Dung dịch sau phản ứng có Fe2+ dư và Cl-.
Kết tủa là Fe(OH)2 → n(Fe(OH)2) = 0,35 mol → n(Fe2+ dư) = n(Fe2+bđ) + 0,2 – 0,15 = 0,35
→ n(Fe2+ bđ) = 0,3 mol
Vậy hỗn hợp ban đầu có: FeCl3: 0,2 mol; CuCl2 0,25 mol và FeCl2 0,3 mol
Tại 12x (s): n(e) = 1,2 mol
Fe3+ + 1e → Fe2+. 2Cl- → Cl2 + 2e.
0,2→ 0,2 → 0,2 1,2 ← 0,6 ← 1,2
Cu2+ + 2e → Cu
0,25 → 0,5→ 0,25
Fe2+ + 2e → Fe
0,25← 0,5 → 0,25
Dung dịch sau điện phân có: Fe2+ (0,3 + 0,2 – 0,25 = 0,25 mol) và Cl‑(0,5 mol)
Khi cho vào AgNO3 thu được Ag (0,25 mol) và AgCl (0,5 mol)
→ m = 98,75 (g)