Dung dịch N sau phản ứng chứa 2 muối tan, nghĩa là lượng AI đã tác dụng hết với CuSO 4 , nên dung dịch N chứa 2 muối Al 2 SO 4 3 và FeSO 4 còn dư (hoặc chưa phản ứng).
2Al + 3 CuSO 4 → Al 2 SO 4 3 + 3Cu ↓
Dung dịch N sau phản ứng chứa 2 muối tan, nghĩa là lượng AI đã tác dụng hết với CuSO 4 , nên dung dịch N chứa 2 muối Al 2 SO 4 3 và FeSO 4 còn dư (hoặc chưa phản ứng).
2Al + 3 CuSO 4 → Al 2 SO 4 3 + 3Cu ↓
Dung dịch M có chứa CuSO 4 và FeSO 4 . Cho Al vào dung dịch M, sau phản ứng tạo thành dung dịch N chứa 3 muối tan. Giải thích mỗi trường hợp bằng phương trình hoá học.
Dung dịch M có chứa CuSO 4 và FeSO 4 . Cho Al vào dung dịch M, sau phản ứng tạo thành dung dịch N chứa 1 muối tan. Giải thích mỗi trường hợp bằng phương trình hoá học.
Hoà tan hoàn toàn một oxit kim loại M (hoá trị không đổi) vào lượng vừa đủ dung dịch H2SO4 10% tạo dung dịch X chứa một muối nồng độ 11,243%.a) Xác định oxit kim loại trên.b) Viết phương trình phản ứng trong các trường hợp sau (kèm điều kiện phản ứng, nếu có).+ Điều chế kim loại tương ứng từ oxit trên.+ Hoà tan oxit trên trong dung dịch NaOH dư.+ Cho dung dịch X tác dụng với dung dịch Na2CO3.
giải thích với
1. Nêu hiện tượng xảy ra và viết phương trình phản ứng hóa học trong mỗi trường hợp sau:
1/Cho kim loại (Cu) vào dung dịch hydrochloric acid HCl
2/Cho dung dịch potassium hydroxide KOH vào dung dịch copper (II) sulfate CuSO\(_4\)
3/CHo dung dịch Barium chloride BaCl\(_2\) vào dung dịch sulfuric acid H\(_2SO_4\)
Có 5 lọ đánh số từ (1) đến (5), mỗi lọ chứa một trong các dung dịch sau: Na2SO4, (CH3COO)2Ba, Al2(SO4)3, NaOH và Ba(OH)2. Biết:
- Rót dung dịch từ lọ (4) vào lọ (3) hoặc (5) đều tạo kết tủa.
- Rót từ từ đến dư dung dịch trong lọ (2) vào lọ (1) thì có kết tủa sau đó kết tủa tan dần tạo thành dung dịch trong suốt.
- Rót từ từ đến dư dung dịch lọ (5) vào lọ (1) thì có kết tủa sau đó kết tủa tan một phần.
Xác định chất tương ứng trong mỗi lọ. Viết phương trình hóa học của các phản ứng.
Cho từ từ đến hết 100 ml dung dịch FeCl2 0,5M vào 100 ml dung dịch AgNO3 1,2M. Sau phản ứng hoàn toàn được m gam kết tủa và dung dịch chứa các muối.
a. Viết phương trình hóa học của phản ứng.
b. Tìm giá trị của m.
Cho một mảnh Mg vào dung dịch chứa hỗn hợp các muối: Al(NO3)3, Cu(NO3)2, Zn(NO3)2, NaNO3, Fe(NO3)3, AgNO3. Sau khi phản ứng xảy ra hoàn toàn thu được dung dịch A và chất rắn B chứa hỗn hợp kim loại. Hãy xác định thành phần các chất có trong dung dịch A và các chất trong B, viết các phương trình phản ứng xảy ra trong các trường hợp sau:
a) Dung dịch A chứa 3 muối.
b) Chất rắn B chứa 4 kim loại.
Cho m gam hỗn hợp gồm Na2O và BaO vào nước thu được dung dịch X. Sục từ từ đến hết 11,2 lít CO2 ở (đktc) vào X thu được dung dịch Y chỉ chứa hai muối và một chất kết tủa. Số mol kết tủa tạo thành phụ thuộc vào số mol CO2 được biểu diễn bằng đồ thị sau:
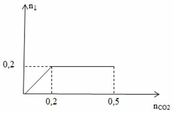
Cho từ từ đến hết dung dịch Y vào 300 ml dung dịch HCl 1M thu được 5,04 lít khí ở (đktc). Biết các phản ứng xảy ra hoàn toàn.Viết các phương trình phản ứng xảy ra và tính giá trị của m.
Hòa tan hoàn toàn 15,8 gam hỗn hợp kim loại bằng dung dịch HCl dư. Sau phản ứng chỉ thu được khí B và dung dịch A có chứa 58,4 gam muối. Cho khí B tác dụng với 8,96 lít khí Cl2 (đktc) rồi lấy sản phẩm hòa tan vào 38,1 gam nước thu được dung dịch D. Lấy 6 gam dung dịch D cho tác dụng với dung dịch AgNO3 dư thấy tạo thành 8,61 gam kết tủa.
Tính hiệu suất phản ứng giữa B và Cl2.