Chọn D
Độ âm điện của C < N < O < F nên độ phân cực của liên kết C – H < N – H < O – H < F – H.
Chọn D
Độ âm điện của C < N < O < F nên độ phân cực của liên kết C – H < N – H < O – H < F – H.
Cân bằng các phương trình sau bằng phương pháp thăng bằng electron
a. P + KClO 3 → P 2 O 5 + KCl
b. S+ HNO 3 → H 2 SO 4 + NO.
c. NH 3 + O 2 → NO + H 2 O
d. NH 3 + O 2 → N 2 + H 2 O
e. H 2 S + O 2 → S + H 2 O
f. Fe 2 O 3 + CO → Fe 3 O 4 + CO 2
g. MnO 2 + HCl → MnCl 2 + Cl 2 + H 2 O
Viết công thức cấu tạo, công thức electron và xác định hóa trị của các nguyên tố
trong các phân tử sau :
- H 2 ; Cl 2 ; Br 2 ; F 2 ; N 2
- HCl; HBr; HI; H 2 O; H 2 S; NH 3 ; PH 3 ; CH 4
- CO 2 ; H 2 CO 3 ; HClO; HNO 2 ;
- C 2 H 2 ; C 2 H 4 ; C 2 H 6 ; CH 3 Cl.
Viết công thức cấu tạo, công thức electron và xác định hóa trị của các nguyên tố
trong các phân tử sau :
- H 2 ; Cl 2 ; Br 2 ; F 2 ; N 2
- HCl; HBr; HI; H 2 O; H 2 S; NH 3 ; PH 3 ; CH 4
- CO 2 ; H 2 CO 3 ; HClO; HNO 2 ;
- C 2 H 2 ; C 2 H 4 ; C 2 H 6 ; CH 3 Cl.
3. Dựa theo độ âm điện, hãy cho biết loại liên kết trong các phân tử: H2S, CH4, K2O, F2O, NaBr.
Bài 5*: Khi phản ứng với H2, các phân tử như F2, N2 cần phải cắt đứt liên kết giữa các nguyên tử. Dựa vào năng lượng liên kết, em hãy dự đoán phản ứng của F2 hay của N2 với H2 sẽ thuận lợi hơn (dễ xảy ra hơn)?
1. Hình 8.1 giải thích sự hình thành phân tử hydrogen (H2) và fluorine (F2) từ các nguyên tử. Theo em, các nguyên tử hydrogen và fluorine đã “bắt chước” cấu hình electron của các nguyên tử khí hiếm nào khi tham gia liên kết?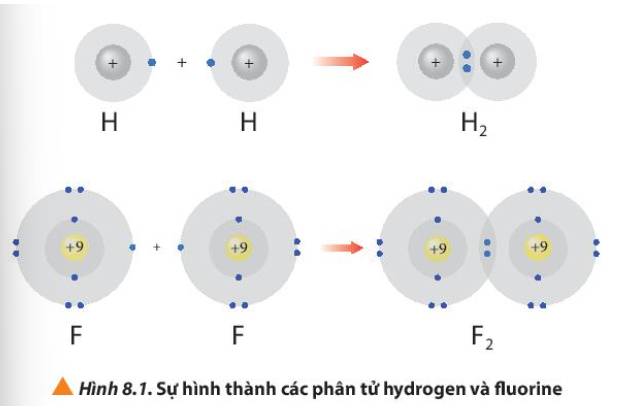
4. Viết ô orbital của lớp electron ngoài cùng cho nguyên tử H và F. Từ đó chỉ ra những AO nào có thể xen phủ tạo liên kết đơn trong các phân tử H2, F2 và HF.
Dựa vào độ âm điện, hãy sắp xếp theo chiều tăng độ phân cực của liên kết giữa 2 nguyên tử trong phân tử các chất sau: CaO, MgO, CH4, AlN, N2, NaBr, BCl3(Cho độ âm điện của O = 3,5; Cl = 3,0; Br = 2,8; Na = 0,9; Mg = 1,2; Ca = 1,0; C = 2,5; H = 2,1; Al = 1,5; N = 3; B =2,0).
A. N2, CH4, BCl3, AlN, NaBr, MgO, CaO
B. N2, CH4, AlN, BCl3, NaBr, MgO, CaO
C. N2, CH4, BCl3, AlN, NaBr, CaO, MgO
D. N2, CH4, AlN, NaBr, BCl3, MgO, CaO
Bài 4. Nước oxy già có tính oxi hóa mạnh, do khả năng oxi hóa của hydrogen peroxide (H2O2).
a) Từ công thức cấu tạo H – O – O – H, hãy xác định số oxi hóa của mỗi nguyên tử.
b) Nguyên tử nguyên tố nào gây nên tính oxi hóa của H2O2. Viết các quá trình oxi hóa, quá trình khử minh họa.