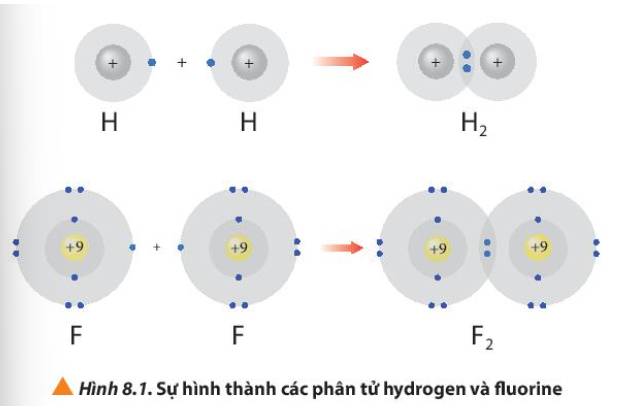
Các câu hỏi tương tự
Viết cấu hình electron nguyên tử của các nguyên tố sau đây : Al, Mg, Na, Ne. Từ các cấu hình đó hãy cho biết các nguyên tử Al, Mg, Na, mỗi nguyên tử nhường mấy electron thì có cấu hình electron giống như của khí hiếm Ne.
Hãy cho biết tại sao các nguyên tử kim loại lại có khuynh hướng nhường electron để trở thành các ion dương ?
Hãy viết cấu hình electron nguyên tử của các nguyên tố sau đây : O, F, Ne. Từ các cấu hình đó hãy cho biết các nguyên tử O, F, mỗi nguyên tử nhận thêm mấy electron thì có cấu hình electron giống như của khí hiếm Ne đứng sau.
Hãy cho biết tại sao các nguyên tử phi kim lại có khuynh hướng nhận thêm electron để trở thành các ion âm ?
Viết cấu hình electron các nguyên tử có số hiệu tương ứng là: Z = 11; Z = 29. Từ đó, hãy cho biết các nguyên tố tương ứng với các nguyên tử đó là nguyên tố kim loại, phi kim hay khí hiếm? Giải thích. *Giải nhanh giúp em ạ
Trong các phân tử sau, phân tử nào có nguyên tử trung tâm không có cấu hình electron bền của khí hiếm?
A. N C l 3
B. H 2 S
C. C O 2
D. P C l 5
Nguyên tử khí hiếm nào có cấu hình electron giống Li+ và nguyên tử khí hiếm nào có cấu hình electron giống O2-.
: Viết cấu hình electron nguyên tử trong các trường hợp sau và xác định chúng là nguyên tử của nguyên tố kim loại, phi kim hay khí hiếm ?
a) Nguyên tử X có 23 electron
b) Nguyên tử R có electron cuối cùng điền vào phân lớp 4p3.
Cho các phân tử CCl4, NF3 Sử dụng thuyết VB và thuyết lai hóa hãy:
- Giải thích sự hình thành liên kết
- Cho biết cấu trúc phân tử (vẽ hình)
- Cho biết loại liên kết được hình thành.
- Cho biết số cặp electron liên kết và không liên kết.
- Cho biết từ tính của phân tử.
Câu 616. Theo quy tắc octet (bát tử): Trong quá trình hình thành liên kết hóa học, nguyên tử các nguyên tố nhóm Á có xu hướng tạo thành lớp vỏ ngoài cùng cóA. 8 electron tương ứng với khí hiểm gần nhất.B. & electron tương ứng với khi hiếm gần nhất ( hoặc 2 electron tương ứng với khí hiểmHelium.).C. 2 electron tương ứng với kim loại gần nhất.D. 6 electron tương ứng với phi kim gần nhất.Câu 617. Nguyên tử nguyên tố nào sau đây có xu hướng đạt cấu hình electron bền vững của khi hiếm argon khi tham...
Đọc tiếp
Câu 616. Theo quy tắc octet (bát tử): Trong quá trình hình thành liên kết hóa học, nguyên tử các nguyên tố nhóm Á có xu hướng tạo thành lớp vỏ ngoài cùng có
A. 8 electron tương ứng với khí hiểm gần nhất.
B. & electron tương ứng với khi hiếm gần nhất ( hoặc 2 electron tương ứng với khí hiểm
Helium.).
C. 2 electron tương ứng với kim loại gần nhất.
D. 6 electron tương ứng với phi kim gần nhất.
Câu 617. Nguyên tử nguyên tố nào sau đây có xu hướng đạt cấu hình electron bền vững của khi hiếm argon khi tham gia hình thành liên kết hóa học
A. Fluorine.
B. Oxygen.
C. Hydrogen.
D. Chlorine.
Câu 618: Liên kết ion là liên kết được tạo thành
A. bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
B. bởi cặp electron chung giữa 1 nguyên tử kim loại và 1 nguyên tử phi kim.
C. bởi cặp electron chung giữa 2 nguyên tử phi kim điển hình.
D. bởi cặp electron chung giữa 2 nguyên tử kim loại.
Câu 619: Liên kết ion thường được tạo thành giữa
A. kim loại điển hình (Na, K...) và phi kim điển hình (F, Cl, O...).
B. kim loại và phi kim bất kỳ.
C. hai phi kim có chênh lệch độ âm điện không đáng
kể.
D. hai phi kim có chênh lệch độ âm điện tương đối (1,7 > Ax>0,4
Câu 620: Liên kết ion trong KC1 là do
A.kali và clo chung 1 electron tạo thành cặp electron chung lệch về phía kali
B. kali và cho góp chung 1 electron tạo thành cặp electron chung lệch về phía cho.
C. nguyên tử kali có nhường electron tạo anion, nguyên tử clo nhận electron tạo cation.
D. nguyên tử kali có nhường electron tạo cation, nguyên tử clo nhận electron tạo anion.
Câu 621: Bản chất liên kết trong phân tử NaCl là
A. liên kết ion.
B. liên kết cộng hóa trị có cực.
C. liên kết cộng hóa trị không cực.
D. liên kết phối trí (cho nhận).
Câu 622: Chất nào dưới đây có liên kết ion :
A. Cl₂
B. HCI
C. NaF
D. O₂
Câu 623: Dãy các chất đều chứa liên kết ion là:
B. Na O, MgO, HCI
D. O2, NaCl, KCI
A. Cl₂, NaCl, H₂O
C. NaF, KCI, KO
Viết cấu hình electron nguyên tử trong các trường hợp sau và xác định chúng là nguyên tử của nguyên tố kim loại, phi kim hay khí hiếm ?
a) Nguyên tử X có điện tích hạt nhân là 29+.
b) Nguyên tử R có electron cuối cùng điền vào phân lớp 3p5 .