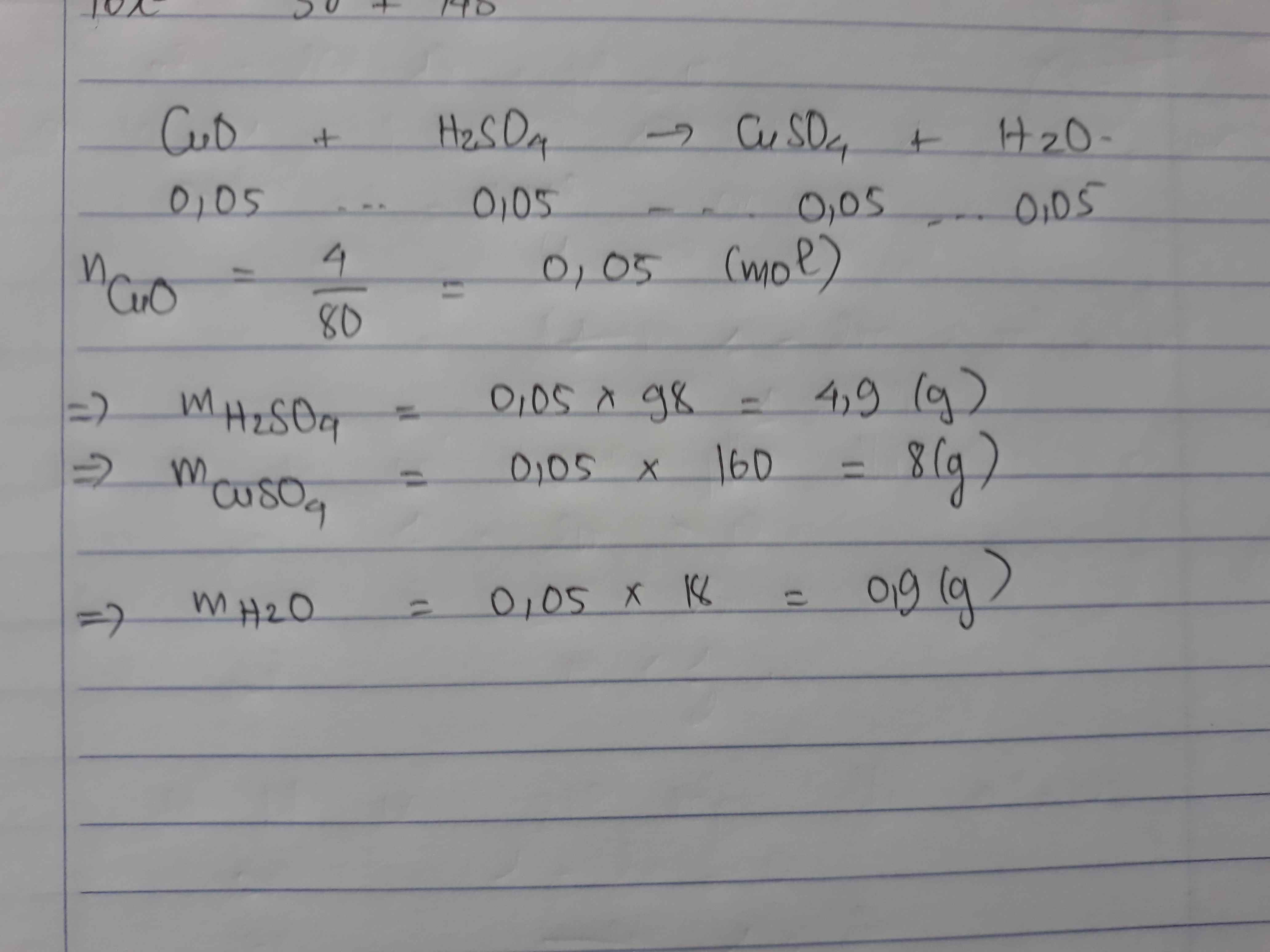$n_{CuO}=\dfrac{4}{80}=0,05(mol)$
$CuO+H_2SO_4\to CuSO_4+H_2O$
Theo PT: $n_{H_2SO_4}=n_{CuSO_4}=n_{H_2O}=0,05$
$\Rightarrow \begin{cases} m_{H_2SO_4}=0,05.98=4,9(g)\\ m_{CuSO_4}=0,05.160=8(g)\\ m_{H_2O}=0,05.18=0,9(g)\end{cases}$
\(n_{CuO}=\dfrac{4}{80}=0,05\left(mol\right)\\ CuO+H_2SO_4\rightarrow CuSO_4+H_2O\\ Chất.tham.gia:CuO,H_2SO_4\\ Chất.sản.phẩm:CuSO_4,H_2O\\ n_{H_2O}=n_{CuSO_4}=n_{H_2SO_4}=n_{CuO}=0,05\left(mol\right)\\ \Rightarrow m_{chất.tham.gia}=m_{CuO}+m_{H_2SO_4}=4+0,05.98=8,9\left(g\right)=m_{chất.sản.phẩm}\)