Dạng đồ thị biểu diễn sự phụ thuộc của nồng độ axit HCL theo thời gian
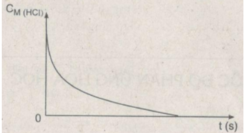
Dạng đồ thị biểu diễn sự phụ thuộc của nồng độ axit HCL theo thời gian

Bảng số liệu sau đây cho biết thể tích khí hiđro thu được theo thời gian của phản ứng giữa kẽm (dư) với axit clohiđric.
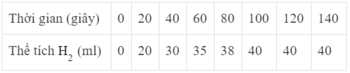
Hãy vẽ đồ thị biểu diễn sự phụ thuộc thể tích khí hiđro theo thời gian.
Từ đồ thị hãy cho biết khoảng thời gian nào phản ứng xảy ra nhanh nhất ?
Ở thời điểm phản ứng kết thúc, hình dạng đồ thị như thế nào ?
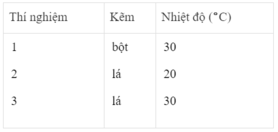
Ba thí nghiệm được tiến hành với những khối lượng Zn bằng nhau và với 50 cm 3 dung dịch loãng H 2 SO 4 2M. PTHH của phản ứng :
Zn + H 2 SO 4 → Zn SO 4 + H 2
Bảng dưới đây cho biết các điều kiện của mỗi thí nghiệm :
Khí hiđro thu được trong mỗi thí nghiệm được ghi lại theo những khoảng cách nhất định về thời gian cho đến khi phản ứng kết thúc, được biểu diễn bằng đồ thị sau :
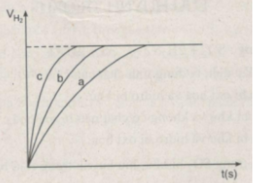
Ghi thể tích khí H 2 trên trục y khi phản ứng kết thúc. Biết rằng ở điều kiện phòng thí nghiệm, 1 mol khí có thể tích là 24 lít và Zn còn dư sau các thí nghiệm.
Ba thí nghiệm được tiến hành với những khối lượng Zn bằng nhau và với 50 cm 3 dung dịch loãng H 2 SO 4 2M. PTHH của phản ứng :
Zn + H 2 SO 4 → Zn SO 4 + H 2
Bảng dưới đây cho biết các điều kiện của mỗi thí nghiệm :
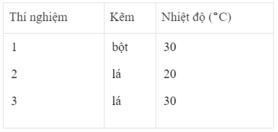
Khí hiđro thu được trong mỗi thí nghiệm được ghi lại theo những khoảng cách nhất định về thời gian cho đến khi phản ứng kết thúc, được biểu diễn bằng đồ thị sau :
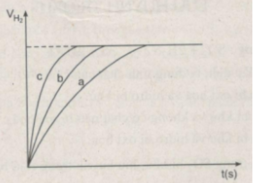
Hãy quan sát đồ thị trên để cho biết các đường cong a, b, c biểu thị cho những thí nghiệm nào ?
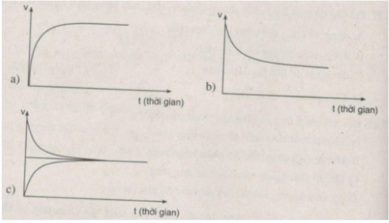
Đồ thị nào sau đây biểu diễn sự biến đổi tốc độ phản ứng thuận theo thời gian ? Sự biến đổi tốc độ phản ứng nghịch theo thời gian ? Trạng thái cân bằng hoá học ?
Ba thí nghiệm được tiến hành với những khối lượng Zn bằng nhau và với 50 cm 3 dung dịch loãng H 2 SO 4 2M. PTHH của phản ứng :
Zn + H 2 SO 4 → Zn SO 4 + H 2
Bảng dưới đây cho biết các điều kiện của mỗi thí nghiệm :
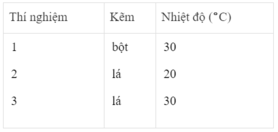
Khí hiđro thu được trong mỗi thí nghiệm được ghi lại theo những khoảng cách nhất định về thời gian cho đến khi phản ứng kết thúc, được biểu diễn bằng đồ thị sau :
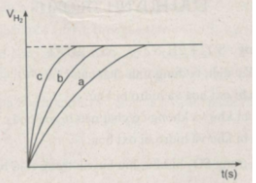
Rút ra được những nhận xét gì khi so sánh hiện tượng phản ứng của :
- Thí nghiệm 1 và thí nghiệm 3 ?
- Thí nghiệm 2 và thí nghiệm 3 ?
Cho 4,8 gam kim loại magie phản ứng vừa đủ với dung dịch axit clohiđric 7,3%. a. Tính thể tích khí hiđro thu được (đktc). b. Tính khối lượng dung dịch axit clohidric đã dùng. c. Tính nồng độ phần trăm của dung dịch muối thu được. d. Tính nồng độ mol của dung dịch axit clohiđric ban đầu biết D = 1, 05g / m * l .
Cho phản ứng : X → Y. Tại thời điểm t1 nồng độ của chất X bằng C1, tại thời điểm t2 (với t2 > t1) nồng độ của chất X bằng C2. Tốc độ trung bình của phản ứng trong khoảng thời gian trên được tính theo biểu thức nào sau đây ?
A. 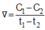
B. 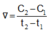
C. 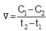
D. 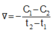
Trong phòng thí nghiêm, bạn em khảo sát thí nghiệm dùng dung dịch HCl dư tác dụng với một khối lượng nhỏ FeS. Cứ sau một khoảng cách thời gian là 20 giây, bạn em lại ghi thể tích khí thoát ra. Kết quả ghi được như sau (xem bảng) :

Vẽ đồ thị biểu diễn thể tích khí H 2 S thu được (trên trục tung) theo thời gian (trên trục hoành).
Điều chế khí oxi bằng cách nhiệt phân KMn O 4 . Kết quả của thí nghiệm được ghi lại như sau :
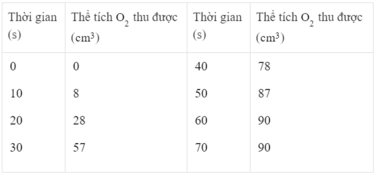
Vẽ đồ thị biểu diễn thể tích khí oxi thu được theo thời gian (trục tung là thể tích khí oxi, trục hoành là thời gian).