Đáp án D
Giải thích :
Al có số hiệu nguyên tử là 13 nên cấu hình electron là :
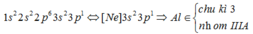
Đáp án D
Giải thích :
Al có số hiệu nguyên tử là 13 nên cấu hình electron là :
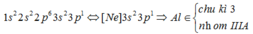
Cho các phát biểu sau:
(1) Cacbon nằm ở ô thứ 6, nhóm IVA, chu kì 2 của bảng tuần hoàn.
(2) Cấu hình electron của nguyên tử cacbon là 1s2 2s2 2p2.
(3) Cacbon là nguyên tử kim loại.
(4) Nguyên tử cacbon có thể tạo được tối đa 4 liên kết cộng hoá trị với các nguyên tử khác. Ngoài ra, trong một số hợp chất nguyên tử cacbon còn có cộng hoá trị hai.
(5) Các số oxi hoá của cacbon là -4, 0, +2 và +4.
Số phát biểu đúng là
A. 4
B. 5.
C. 2
D. 3.
Cho các đặc điểm sau đây
a, Số electron lớp ngoài cùng của nguyên tử
b, Số oxi hoá của các nguyên tố trong hợp chất
c, cấu tạo mạng tinh thể của các đơn chất
d, bán kính nguyên tử
Các đặc điểm là đặc điểm chung cho các kim loại nhóm IA?
A. a, b, c
B. b, c, d
C. a, c
D. b, c
Cho các phát biểu sau:
(1) Các nguyên tố nhóm A trong bảng tuần hoàn là các nguyên tố nhóm s
(2) Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố trong cùng một chu kì được lặp đi lặp lại sau mỗi chu kì
(3) Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố trong một nhóm A biến đổi một cách không tuần hoàn
(4) Số thứ tự của nhóm (IA,IIA,..) cho biết số electron ở lớp ngoài cùng nhưng không cho biết số electron hóa trị trong nguyên tử của các nguyên tố đó
(5) Nhóm VIIIA là nhóm khí hiếm
(6) Nguyên tử của tất cả các nguyên tố trong nhóm khí hiếm đều có 8 electron ở lớp ngoài cùng
Số phát biểu đúng là:
A. 5
B. 2
C. 3
D. 4
Mô tả nào dưới đây không phù hợp với nhôm?
A. Trong hợp chất, số oxi hóa của Al là +3.
B. Cấu hình electron [Ne]3s23p1.
C. Tinh thể cấu tạo lập phương tâm diện.
D. Ở ô thứ 13, chu kì 2, nhóm IIIA.
Mô tả nào dưới đây không phù hợp với nhôm?
A. Ở ô thứ 13, chu kì 2, nhóm IIIA
B. Cấu hình electron [Ne] 3s2 3p1
C. Tinh thể cấu tạo lập phương tâm diện
D. Mức oxi hóa đặc trưng +3
Cho các phát biểu sau:
(1) Trong chu kì 2, 3 số electron lớp ngoài cùng tăng dần từ 1 đến 8
(2) Chu kì nào cũng mở đầu là kim loại điển hình, kết thúc là một phi kim điển hình
(3) Nguyên tử của nguyên tố hóa học trong cùng nhóm A có cùng bán kính nguyên tử
(4) Nguyên tử của nguyên tố hóa học trong cùng nhóm A có cùng số lớp electron
(5) Nguyên tử của nguyên tố hóa học trong cùng nhóm A có cùng cấu hình electron lớp ngoài cùng
(6) Các nguyên tố nhóm A trong bảng tuần hoàn là các nguyên tố nhóm d
Số phát biểu đúng là:
A. 1
B. 2
C. 3
D.4
Cho các cấu hình electron sau
(a) [Ne]3s1 (b) [Ar]4s2 (c) 1s22s1 (d) [Ne]3s23p1
Các cấu hình trên lần lượt ứng với các nguyên tử (biết số hiệu nguyên tử 20Ca, 3Li, 13Al, 11Na)
A. Ca, Na, Li, Al.
B. Na, Li, Al, Ca.
C. Na, Ca, Li, Al
D. Li, Na, Al, Ca.
Cho các cấu hình electron sau
(a) [Ne]3s1 (b) [Ar]4s2(c) 1s22s1(d) [Ne]3s23p1
Các cấu hình trên lần lượt ứng với các nguyên tử (biết số hiệu nguyên tử 20Ca, 3Li, 13Al, 11Na)
A. Ca, Na, Li, Al.
B. Na, Li, Al, Ca.
C. Na, Ca, Li, Al.
D. Li, Na, Al, Ca.
Cho các phát biểu sau:
(a) Khi điện phân dung dịch CuSO4 (điện cực trơ), tại anot H2O bị khử tạo ra khí O2.
(b) Để lâu hợp kim Fe-Cu trong không khí ẩm thì Fe bị ăn mòn điện hóa học.
(c) Nguyên tắc điều chế kim loại là khử ion kim loại thành kim loại.
(d) Các kim loại có độ dẫn điện khác nhau do mật độ electron tự do của chúng không giống nhau.
(e) Các kim loại kiềm đều có mạng tinh thể lập phương tâm diện, cấu trúc tương đối rỗng.
Số phát biểu đúng là
A. 4
B. 3
C. 5
D. 2