a)
\(n_{Fe_2O_3}=\dfrac{24}{160}=0,15\left(mol\right)\\ n_{H_2SO_4}=0,2.2,5=0,5\left(mol\right)\\ PTHH:Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O.\\ Vì:\dfrac{0,15}{1}< \dfrac{0,5}{3}\)
=> H2SO4 dư, Fe2O3 hết => Tính theo Fe2O3
Ta có:
\(n_{H_2SO_4\left(dư\right)}=0,5-\left(0,15.3\right)=0,05\left(mol\right)\\ \Rightarrow m_{H_2SO_4\left(dư\right)}=0,05.98=4,9\left(g\right)\)
b) \(n_{Fe_2\left(SO_4\right)_3}=n_{Fe_2O_3}=0,15\left(mol\right)\)
=> \(m_{Fe_2\left(SO_4\right)_3}=0,15.400=60\left(g\right)\)
c) \(V_{ddFe_2\left(SO_4\right)_3}=V_{ddH_2SO_4}=200\left(ml\right)=0,2\left(l\right)\)
Vậy: \(C_{MddFe_2\left(SO_4\right)_3}=\dfrac{0,15}{0,2}=0,75\left(M\right)\)
nFe2O3= 24/160 = 0,15 mol
nH2SO4 = 0,2.2,5= 0,5 mol
Fe2O3 + 3H2SO4 -> Fe2(SO4)3 + 3H2O
0,15 0,5
ta có 0,15/1 < 0,5/3
=> H2SO4 dư
Fe2O3 +3H2SO4 -> Fe2(SO4)3 +3H2O
0,15 0,45 0,15
nH2SO4 dư = 0,5-0,45=0,05mol
mH2SO4 dư = 05.98=4,9(g)
b, mFe2(SO4)3 = 0,15.400=60(g)
c, C(Fe2(SO4)3) = n/V = 0,15/ 0,2=0,75M
C(H2SO4) dư = n/V = 0,05/0,2= 0,25 M












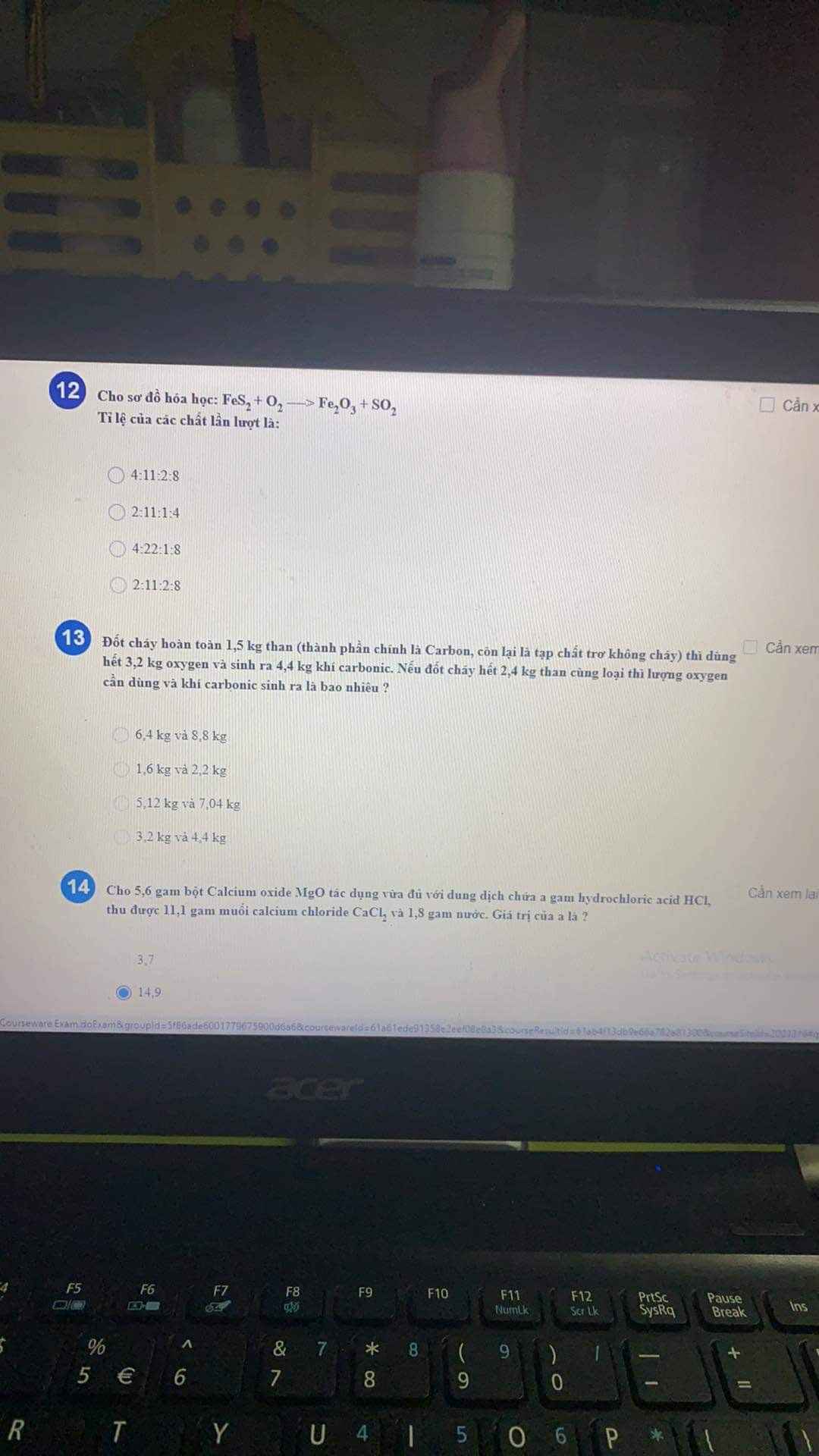



 Mn ơi, giải hộ mik câu này với! Tối nay mik phải nộp rồi ạ! Cảm ơn mn nhiều lắm!
Mn ơi, giải hộ mik câu này với! Tối nay mik phải nộp rồi ạ! Cảm ơn mn nhiều lắm!




