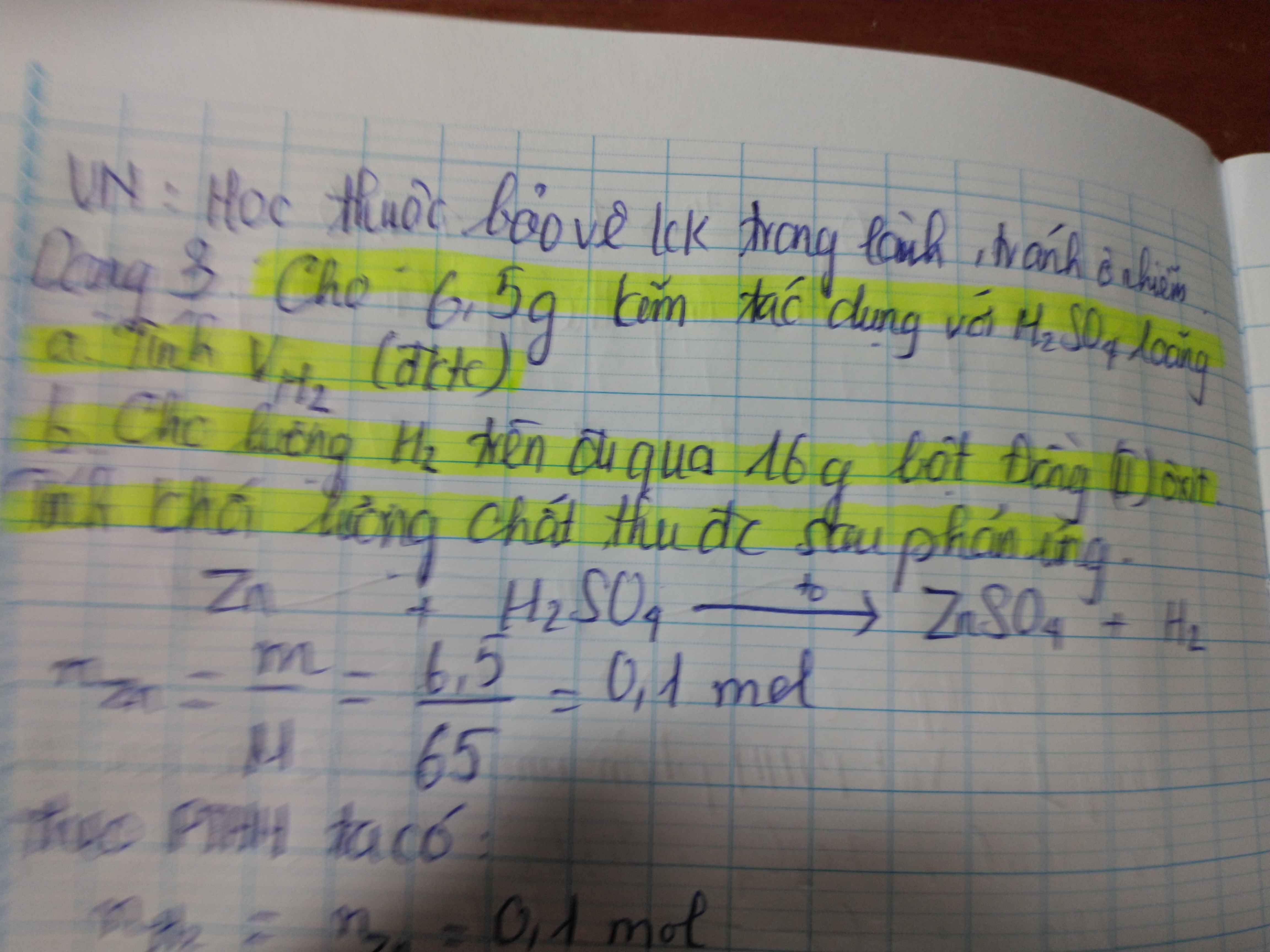\(a) Zn + H_2SO_4 \to ZnSO_4 + H_2\\ n_{H_2} = n_{Zn} = \dfrac{6,5}{65} = 0,1(mol)\\ V_{H_2} =0,1.22,4 = 2,24(lít)\\ b) n_{CuO} = \dfrac{16}{80} = 0,2(mol)\\ CuO + H_2 \xrightarrow{t^o} Cu + H_2O\\ n_{CuO} = 0,2 > n_{H_2} = 0,1 \to CuO\ text{dư}\\ n_{CuO\ pư} = n_{Cu} = n_{H_2O} = n_{H_2} = 0,1(mol)\\ m_{Cu} = 0,1.64 = 6,4(gam)\\ m_{H_2O} = 0,1.18 = 1,8(gam)\\ m_{CuO\ dư} = 16 -0,1.80 = 8(gam) \)
Đúng 1
Bình luận (0)
Các câu hỏi tương tự
 Các bạn giúp mình hoàn thiện 2 bảng naày với. Nhanh hộ minhf nha, mình đang cần gấp
Các bạn giúp mình hoàn thiện 2 bảng naày với. Nhanh hộ minhf nha, mình đang cần gấp
tính số gam nước sinh ra khi đốt cháy 42 lít khí hidro với 16 lít khí oxi (các khí đều ở đktc)
Mọi người giúp mình với nha! Mình đang cần gấp
ng tử x,y,z lần lượt có tổng số hạt là:21,28,52 và có số N nhiều hơn số P ko quá 1 hạt,tìm tên và ký hiệu hóa học của x,y,z'
giúp mình nha mình cần gấp
![]()
Giải thích tại sao khi để ngọn lửa đến gần là cồn đã bắt cháy
Giúp mình với nha các bạn, mình cần gấp nên sẽ tick cho bạn nào trả lời nhanh và đúng nhất! ^^
CÁM ƠN CÁC BẠN NHA!!!
Trình bày theo cách hiểu của các bạn nha, không chép trên mạng
ng tử x,y,z lần lượt có tổng số hạt là:21,28,52 và có số N nhiều hơn số P ko quá 1 hạt,tìm tên và ký hiệu hóa học của x,y,z'.các bạn có thể trình bày đầy đủ ko viết tắt càng tốt.giúp mình nha mình cần gấp.
![]()
 giúp mình với mình đang cần gấp
giúp mình với mình đang cần gấp
Giúp mình với ạ. Mình cần gấp

Giúp mình với mình cần gấp ạ

Giúp mình vs mình cần gấp ạ