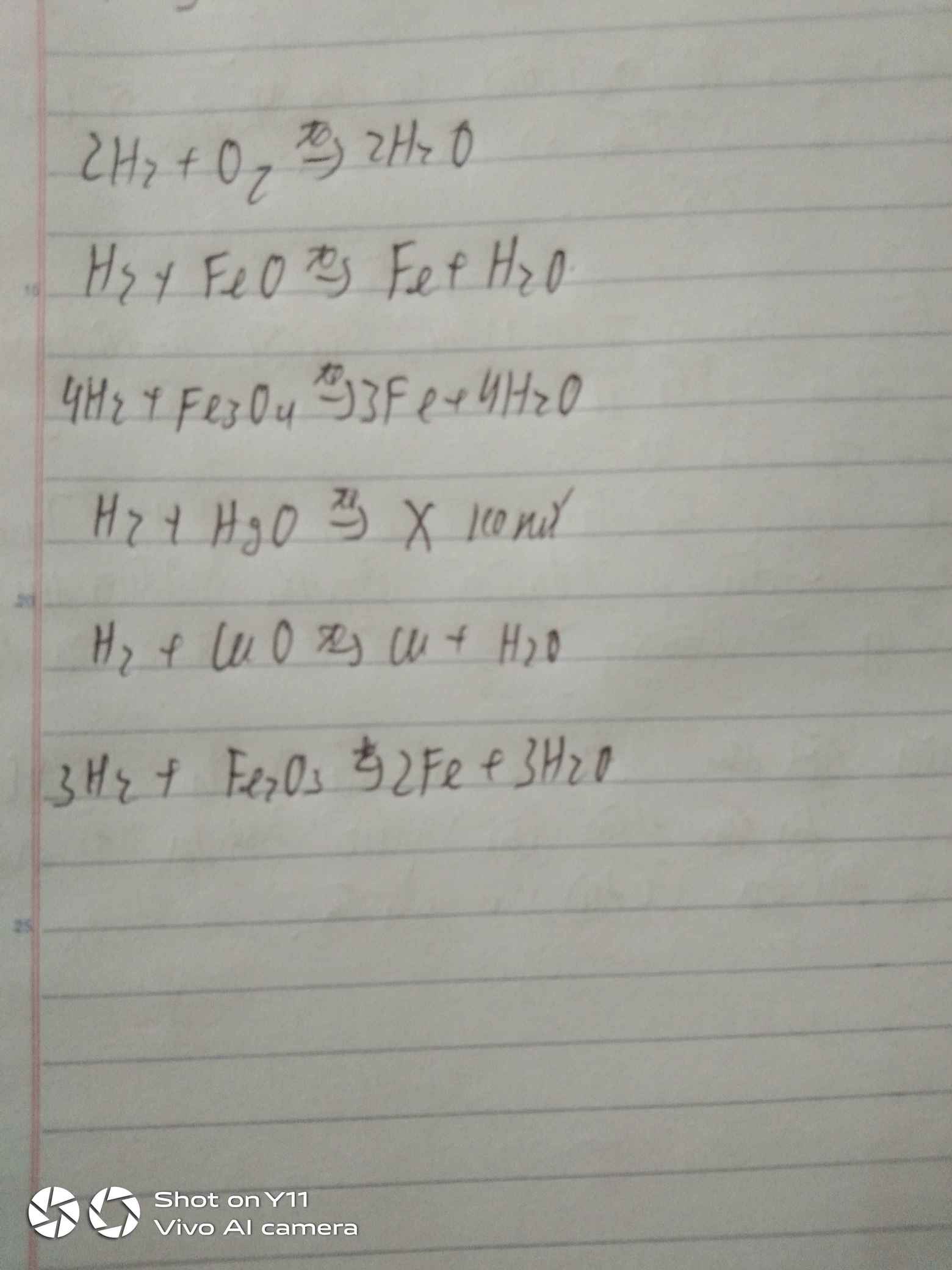Dạng I: Viết PTHH của phản ứng
Bài 1: 1) Viết PTHH của phản ứng xảy ra (ghi rõ điều kiện phản ứng nếu có) khi cho H2 lần lượt tác dụng với các chất: O2, PbO, Fe2O3, Fe3O4, CuO.
2) Cacbon oxit (CO) có tính chất tương tự như H2 (tính khử). Viết PTHH của phản ứng xảy ra (ghi điều kiện phản ứng nếu có) khi cho CO lần lượt tác dụng với: O2; CuO; Fe3O4?
Bài 2: Xác định các chất A; B và viết PTHH (ghi rõ điều kiện phản ứng) thực hiện chuyển đổi hóa học sau:
H2O  A
A  B
B  Fe3O4
Fe3O4
Dạng II: Nhận biết – Tách và tinh chế chất:
Bài 3: Có 4 bình khí A, B, C, D mỗi bình chứa 1 trong các chất khí sau: khí cacbonic, khí oxi, khí hiđro, không khí. Biết rằng:
- Khí trong bình A làm đục nước vôi trong.
- Hỗn hợp của khí trong bình B và D là hỗn hợp nổ.
- Khí D làm CuO (màu đen) chuyển sang màu đỏ khi nung nóng.
Xác định chất khí đựng trong các bình A, B, C, D và viết PTHH của các phản ứng xảy ra?
Bài 4: Có hỗn hợp khí gồm H2, CO2.
1) Trình bày cách để loại bỏ CO2 ra khỏi hỗn hợp? Viết PTHH của phản ứng xảy ra?
2) Tách riêng H2 và CO2 ra khỏi hỗn hợp trên?
Dạng III: Phương pháp bảo toàn khối lượng và bảo toàn nguyên tố
Bài 5: Dẫn luống khí H2 dư qua ống sứ đựng 24 gam hỗn hợp gồm CuO và Fe2O3 ( ) nung nóng. Sau khi phản ứng xảy ra hoàn toàn thu được m gam chất rắn.
) nung nóng. Sau khi phản ứng xảy ra hoàn toàn thu được m gam chất rắn.
1) Viết PTHH của phản ứng xảy ra?
2) Không dựa vào PTHH hãy:
a) Tính thể tích khí H2 (đktc) đã tham gia phản ứng?
b) Tính m?
Bài 6: Dẫn hỗn hợp X gồm H2 và CO từ từ đến dư qua ống sứ đựng 19,6g hỗn hợp A gồm CuO và Fe3O4 (trong đó CuO chiếm 40,82% về khối lượng), sau khi các phản ứng xảy ra hoàn toàn thu được hỗn hợp khí và hơi Y (gồm CO2 và hơi nước). Chất rắn B thu được trong ống sứ khối lượng giảm m gam so với hỗn hợp A ban đầu.
1) Viết PTHH của phản ứng xảy ra?
2) Tính m và khối lượng của hỗn hợp B?
3) Khối lượng của Y nặng hay nhẹ hơn khối lượng hỗn hợp X ban đầu? bao nhiêu gam? Tính tổng thể tích hỗn hợp A đã tham gia phản ứng?
Bài 7: Hỗn hợp X gồm Al; Mg; Zn.
- Cho m gam hỗn hợp X tác dụng hết với dung dịch H2SO4 loãng thấy thoát ra 8,96 lít H2 (đktc).
- Mặt khác, đốt cháy hoàn toàn m gam hỗn hợp X cần dùng vừa đủ V lít O2 (đktc).
1) Viết PTHH của phản ứng xảy ra?
2) Tính V? (Phương pháp ghép ẩn)
Dạng IV: Bài toán: Tính theo PTHH – tăng, giảm khối lượng
Bài 8: Người ta tiến hành thí nghiệm sau:
- Đặt lên 2 đĩa cân (cân Robecvan): Đĩa cân A: cốc đựng dung dịch HCl; đĩa cân B: cốc đựng dung dịch H2SO4 loãng. Cân ở vị trí thăng bằng.
- Thêm vào cốc A một dây Mg có khối lượng 3,6g; thêm vào cốc B lá nhôm có khối lượng 5,4g. Để cho toàn bộ kim loại tan hết.
1) Viết PTHH của các phản ứng xảy ra?
2) So sánh thể tích khí thoát ra ở 2 cốc?
3) Xác định trạng thái của cân sau thí nghiệm? Cần phải thêm nước vào cốc nào? Bao nhiêu gam nước để cân trở lại vị trí thăng bằng?
Bài 9: Người ta tiến hành thí nghiệm sau:
- Đặt lên 2 đĩa cân (cân Robecvan): Đĩa cân A: cốc đựng dung dịch HCl; đĩa cân B: cốc đựng dung dịch H2SO4 loãng. Cân ở vị trí thăng bằng.
- Thêm vào cốc A vài viên Zn có khối lượng a gam; thêm vào cốc B lá nhôm có khối lượng b gam. Sau khi toàn bộ kim loại tan hết, thấy cân vẫn ở vị trí thăng bằng.
1) Viết PTHH của các phản ứng xảy ra
2) Tính a/b?
Dạng V: Bài toán: Xác định thành phần hỗn hợp – Nồng độ dung dịch
Bài 10: Khử hoàn toàn 32g hỗn hợp X gồm CuO và Fe2O3 bằng khí H2 ở nhiệt độ cao. Sau phản ứng thu được 24g hỗn hợp Y gồm 2 kim loại.
1) Viết PTHH của phản ứng xảy ra?
2) Tính thể tích H2 (đktc) đã tham gia phản ứng?
3) Tính thành phần % về khối lượng mỗi oxit trong X?
Bài 11: Cho 6,06g hỗn hợp A gồm Al và Zn tác dụng với 200g dung HCl 6,935%. Sau khi phản ứng xảy ra hoàn toàn thu được dung dịch B và thoát ra 4,032 lít H2 (đktc).
1) Viết PTHH của phản ứng xảy ra?
2) Chứng tỏ rằng, hỗn hợp A tan hết; HCl còn dư.
3) Tính tổng khối lượng muối có trong dung dịch B?
4) Tính thành phần % về khối lượng mỗi kim loại trong A?
5) Tính nồng độ % của các chất trong dung dịch B?
Bài 12: Hoà tan 3,87g hỗn hợp kim loại gồm Mg và Al trong 250 ml dung dịch HCl 2M thu được dung dịch A và khí B.
1) Viết PTHH của phản ứng xảy ra?
2) Chứng minh rằng sau phản ứng với Mg và Al thì axit vẫn còn dư.
3) Nếu thể tích khí B thu được là 4,368 lit (đktc):
a) Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu?
b) Tính nồng độ mol của các chất trong dung dịch A? Coi thể tích dung dịch không thay đổi trong quá trình phản ứng?
Bài 13: Khử hoàn toàn 24g hỗn hợp X gồm CuO và Fe2O3 bằng V lít (đktc) hỗn hợp khí A gồm CO và H2 (vừa đủ). Sau phản ứng thu được m gam hỗn hợp Y (gồm 2 kim loại); hỗn hợp khí và hơi B (CO2; hơi nước) nặng hơn hỗn hợp A ban đầu 6,4g.
1) Viết PTHH của các phản ứng xảy ra?
2) Tính m và V?
3) Tính khối lượng mỗi oxit trong X?
Dạng VI: Bài toán: Xác định CTHH của chất
Bài 14: Hoà tan hoàn 18,4g kim loại M (hoá trị II) và N (hoá trị III) trong dung dịch HCl thu được dung dịch Q và 11,2 lít H2 (đktc). Cô cạn dung dịch Q thu được m gam muối khan.
1) Tính m?
2) Xác định tên 2 kim loại M, N. Biết rằng trong hỗn hợp tỉ lệ số mol nM : nN = 1: 1và 2MN < MM < 3MN
Bài 15: Khi lấy 6,72 lít H2 ở trên khử vừa đủ 19,6 gam hỗn hợp CuO và FexOy tạo ra hỗn hợp kim loại C, ngâm hỗn hợp kim loại C trong dung dịch HCl dư thu được 3,36 lít H2. Biết: các thể tích đo ở điều kiện tiêu chuẩn; Cu không tác dụng với dung dịch HCl.
1) Tính khối lượng hỗn hợp C.
2) Xác định công thức oxit sắt?
Bài 16: Cho 11,6 gam MxOy vào ống sứ, nung nóng và dẫn 8,96 lít khí CO (đktc) đi qua. Khi phản ứng xảy ra hoàn toàn thu được chất rắn và hỗn hợp khí Y có tỉ khối so với khí oxi là 1,125. Tìm công thức oxit.
Bài 17: Khử hoàn toàn 3,48g một oxit kim loại RxOy cần dùng 1,344 lít H2. Toàn bộ lượng kim loại thu được cho tác dụng với dung dịch HCl dư thu được 1,008 lít khí. Các thể tích khí đo ở đktc. Xác định kim loại M và oxit của nó?