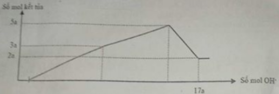
Hòa tan hết 12,06 gam hỗn hợp Mg và Al2O3 trong dung dịch chứa HCl 0,5 M và H2SO4 0,1M. Sau khi phản ứng kết thúc thu được dung dịch X. Cho từ từ dung dịch NaOH 1M vào dung dịch X, phản ứng được biểu diễn theo sơ đồ
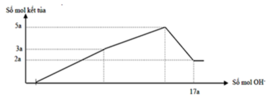
Nếu cho từ từ V ml dung dịch NaOH 0,3M và Ba(OH)2 0,1M vào dung dịch X, thu được kết tủa lớn nhất, lấy kết tủa nung ngoài không khí đến khối lượng không đổi thu được m gam rắn khan. Giá trị của m là
A. 37,860
B. 53,124
C. 48,152
D. 41,940
Giải thích:
Dd X + NaOH → Mg(OH)2 + Al(OH)3
Lượng kết tủa khi NaOH dư là nMg(OH)2 = 2a
→ lượng kết tủa tối đa là nAl(OH)3 = n↓ - nMg(OH)2 = 5a - 2a =3a
→ nMg : nAl2O3 = 2a : = 4 : 3
Mà mhỗn hợp = 24nMg + 102nAl2O3 = 12,06 → nMg = 0,12 mol và nAl2O3 = 0,09 mol
→ a = 0,06 mol → nOH = 17a = 1,02 = nH+ (X) + 2nMg + 8nAl2O3 = nH+(X) + 0,96 → nH+(X) = 0,06 mol
Bảo toàn điện tích trong dung dịch X có nH+(X) + 2nMg2+ + 3nAl3+ = nCl- + 2nSO4 = 0,84
Mà nCl : nSO4 = 5 : 1 nên nCl- = 0,6 mol và nSO4 = 0,12 mol
X có Cl- : 0,6 mol SO42- : 0,12 mol, H+ : 0,06 mol, Al3+ : 0,18 mol và Mg2+ : 012 mol
Dd thêm vào có Ba2+ : x mol, Na+ : 3x mol ; OH- : 5x mol
Để thu được kết tủa tối đa thì ta có tạo kết tủa Al(OH)3 và Mg(OH)2 tối đa
nOH- = 5x = 0,18.3 +0,12.2 =0,78 mol
Khi đó Ba2+ : 0,156 → nBaSO4= 0,12 → ↓ BaSO4 : 0,12 mol; Al(OH)3 : 0,18 mol; Mg(OH)2 : 0,12 mol
→ nung thu được 0,12 mol BaSO4; 0,09 mol Al2O3 và 0,12 mol MgO
→ m =41,94
Đáp án D