Có phản ứng:
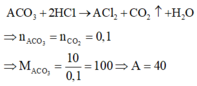
Vì A có N = Z và Z + N = 40 nên Z = 20
Khi đó cấu hình electron của A là 1s22s22p63s23p64s2.
Đáp án D
Có phản ứng:
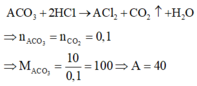
Vì A có N = Z và Z + N = 40 nên Z = 20
Khi đó cấu hình electron của A là 1s22s22p63s23p64s2.
Đáp án D
Cho 10 gam ACO3 tác dụng với dung dịch HCl dư thì thu được 2,24 lít khí CO2 (đktc). Cấu hình electron của A là (biết A có số hạt proton bằng số hạt nơtron)
A. 1s22s22p6
B. 1s22s22p63s2
C. 1s22s22p63s23p4
D. [Ar]4s2
Tổng số các hạt cơ bản trong nguyên tử A là 87 hạt. Số hạt mang điện gấp
1,807 lần số hạt không mang điện. Cấu hình electron thu gọn của nguyên tử A là
A. [Ar]3d84s2
.B. [Ar]4s2,3d8
C.[Ar]4s2.
D.[Ar]3d104s24p4
Một ion M3+ có tổng số hạt proton, nơtron, electron là 79, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 19. Cấu hình electron của nguyên tử M là
A. [Ar]3d54s1. B.[Ar]3d64s2. C. [Ar]3d64s1. D. [Ar]3d34s2.
Cho 10 gam CaCO3 tác dụng hoàn toàn với dung dịch HCl dư thu được V lít khí CO2 (đktc). Giá trị V của là
A. 5,60.
B. 2,24.
C. 3,36.
D. 4,48.
Câu 10: Số hạt proton có trong 0,125 mol nguyên tử là
A. 2,03175.1024. B. 1,9565.1024. C. 1,0535. 1024. D. 9,7825. 1023.
Câu 11: Nguyên tử X có cấu hình electron là 1s22s22p63s2. Số hạt proton của X là
A. 10. B. 12. C. 20. D. 24.
Câu 12: Nguyên tử X có 6 electron. Điện tích hạt nhân của nguyên tử X là
A. -6. B. 6+. C. 6. D. 0
Câu 13: Dãy thứ tự mức năng lượng nào sau đây không đúng?
A. 2p < 3s < 3p. B. 3s < 3p < 3d. C. 3p < 3d < 4s. D. 3p < 4p < 4d.
Câu 14: Nguyên tử X và Y có đặc điểm sau:
- X có 2 lớp electron, có 4 electron ở phân mức năng lượng cao nhất.
- Y có 3 lớp electron, có 2 electron ở lớp ngoài cùng.
Phát biểu nào sau đây đúng?
A. X và Y đều là kim loại. B. X và Y đều là phi kim.
C. X là kim loại, Y là phi kim. D. X là phi kim, Y là kim loại.
Câu 15: Nguyên tử X có 4 lớp electron. Số electron tối đa có thể có ở lớp thứ N của X là
A. 6. B. 8. C. 18. D. 32.
Câu 16: Nguyên tử X có tổng số hạt cơ bản là 46 và có số khối bằng 31. Tổng số hạt mang điện của nguyên tử X là
A. 14. B. 15. C. 28. D. 30.
Câu 17: Trong tự nhiên, nitơ có hai đồng vị bền: 14N, 15N và oxi có ba đồng vị bền: 16O, 17O, 18O. Số loại phân tử N2O tối đa có thể được tạo nên từ các đồng vị trên là
A. 6. B. 9. C. 12. D. 18.
Câu 18: Mg có 2 đồng vị là X và Y. Đồng vị X có số khối là 24. Nguyên tử khối trung bình của Mg là 24,4. Tỉ lệ số nguyên tử giữa X và Y là 3/2. Số khối của đồng vị Y là
A. 27. B. 28. C. 25. D. 26.
Câu 19: Nguyên tử 26Fe có số electron trên phân lớp p là
A. 26. B. 20. C. 12. D. 8.
Câu 20: Cho cấu hình electron của các nguyên tử sau:
(X) 1s2 (Y) 1s22s22p5 (Z) 1s22s22p63s23p1
(R) 1s22s22p63s23p6 (T) 1s22s22p63s23p64s2
(M) 1s22s22p63s23p63d54s1
Số nguyên tử kim loại là
A. 2. B. 3. C. 4. D. 5.d
Câu 21:coi hình

Cho 8,42 gam hỗn hợp A gồm Na2CO3, NaOH, CaCO3, Ca(OH)2 tác dụng với dung dịch HCl dư thu được 0,672 lít khí CO2 (đktc) và dung dịch B. Cô cạn dung dịch B thu được 4,68 gam muối khan của natri và m gam muối của canxi. Giá trị của m là:
A. 2,22 gam
B. 4,44 gam
C. 6,66 gam
D. 8,88 gam
Nung m gam hỗn hợp X gồm hai muối cacbonat trung tính của 2 kim loại A và B đều có hóa trị 2. Sau một thời gian thu được 3,36 lít CO2 đktc và còn lại hỗn hợp rắn Y. Cho Y tác dụng hết với dung dịch HCl dư thu thêm 3,36 lít khí CO2 (đktc). Phần dung dịch đem cô cạn thu được 32,5 gam hỗn hợp muối khan. Giá trị của m là ?
Một nguyên tố thuộc nhóm VIIA có tổng số proton, nơtron và electron trong nguyên tử bằng 28. Cấu hình electron của nguyên tố đó là
A. 1s22s22p63s23p5B. 1s22s22p5 C. 1s22s22p63s23p6D. 1s22s22p6
Bài 8. a) Cho 200ml dung dịch HCl 2M tác dụng với lượng dư KMnO4 thu được dung dịch A, V1 lít khí Cl2 (đktc). b) Cho 200ml dung dịch HCl 2M tác dụng với lượng dư MnO2 thu được dung dịch B, V2 lít khí Cl2 (đktc). - Viết PTHH của phản ứng xảy ra. - Tính thể tích khí Cl2 thu được (V1, V2). Mọi người giúp mình với ạ mình thật sự rất cần