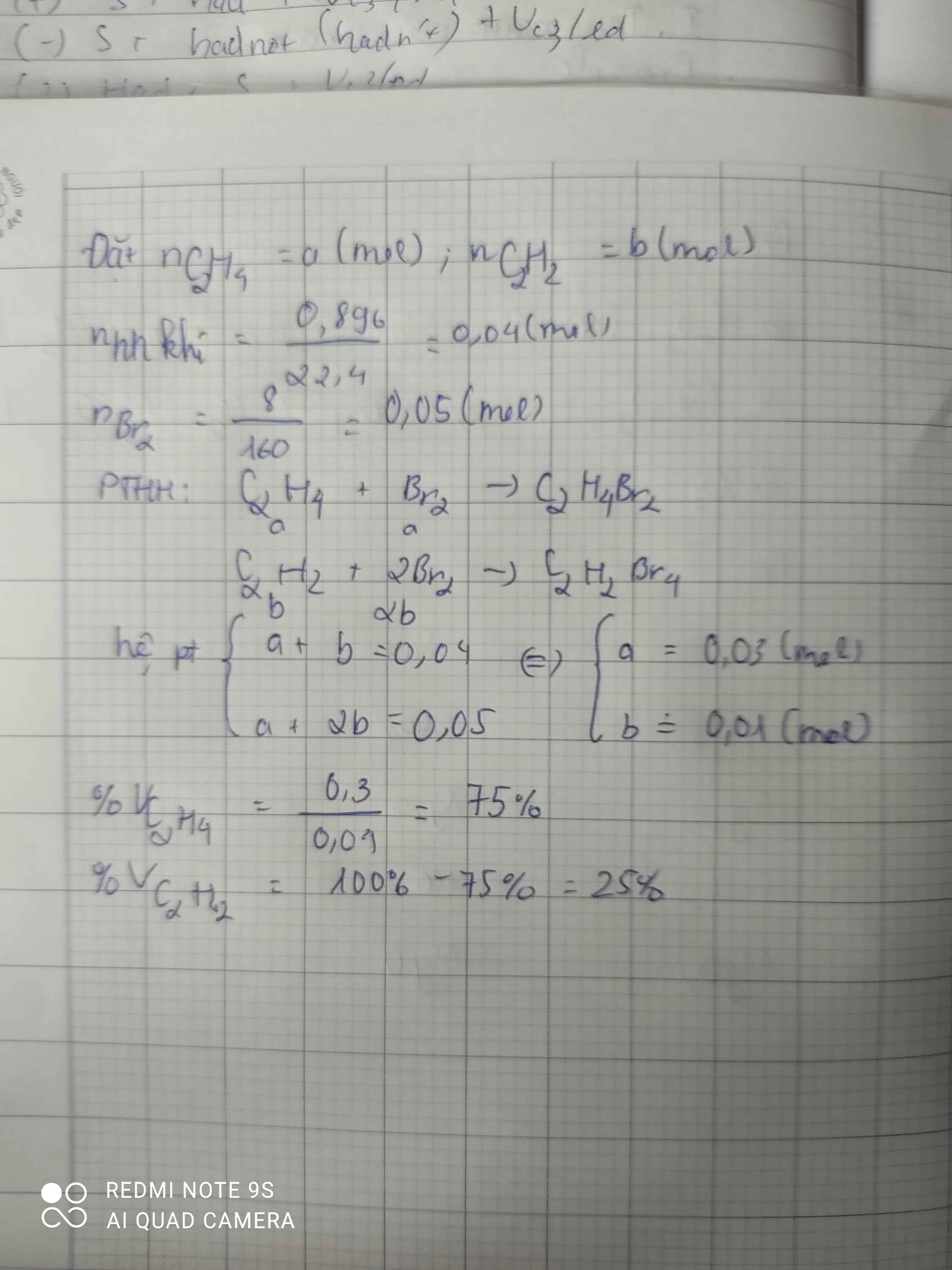Ta có Cùng điều kiện -> Quy số lít về số mol.n(hh ban đầu) = 20 mol; n(hh sau) = 16 lít
=> H2 phản ứng mất 4 lít => C2H2 có 2 lít và CH4 có 8 lít
a.\(n_{hh}=\dfrac{V_{hh}}{22,4}=\dfrac{0,896}{22,4}=0,04mol\)
\(n_{Br_2}=\dfrac{m_{Br_2}}{M_{Br_2}}=\dfrac{8}{160}=0,05mol\)
Gọi \(n_{C_2H_2}\) là x => \(V_{C_2H_2}=22,4x\)
\(n_{C_2H_4}\) là y => \(V_{C_2H_4}=22,4y\)
\(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
x 2x x ( mol )
\(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
y y y ( mol )
Ta có hpt:
\(\left\{{}\begin{matrix}22,4x+22,4y=0,896\\2x+y=0,05\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x=0,01\\y=0,03\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}V_{C_2H_2}=0,01.22,4=0,224\\V_{C_2H_4}=0,03.22,4=0,672\end{matrix}\right.\)
\(\%V_{C_2H_2}=\dfrac{0,224}{0,896}.100=25\%\)
\(\%V_{C_2H_4}=100-25=75\%\)
b.\(m_{Sp}=0,01.186+0,03.346+0,03.188=16,02g\)
( Em cảm ơn anh Kudo Sinichi rất nhiều ạ!! )