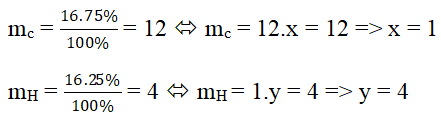Đặt công thức hóa học của khí A là CxHy
Khối lượng mol của khí A:
29.0,552=15 (g)
Ta có: \(m_C=\dfrac{16.75}{100}=12\left(g\right)\)
=>x=1
\(m_H=\dfrac{16,25}{100}=4\left(g\right)\)
=>y=4
=>CTHH của A: CH4
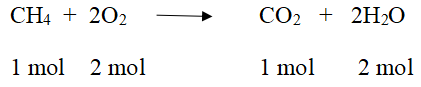
Ta có: \(CH_4+2O_2\rightarrow CO_2+2H_2O\)
Thể tích O2 = 2 lần thể tích khí CH4 nên thể tích O2 đủ để đốt cháy 11 l khí A là 11,2 l . 2=22,4 l
Giải chi tiết:
dA/kk = 0,552 ⇒ Khối lượng mol của khí A: 29.0,552 = 16 (g)
Đặt CTHH của khí A là \(C_xH_y\)
Công thức hóa học của khí A là: \(CH_4\)
Phương trình phản ứng:
Tỉ lệ số mol cũng chính là tỉ lệ thể tích.
Theo phương trình \(n_{O_2}=2.n_{CH_4}\Rightarrow V_{O_2}=2.V_{CH_4}=2.11,2=22,4\left(l\right)\)
Nếu bài này không đúng thì mình nhận lời góp ý của bạn để hoàn thiện hơn.