- Nồng độ biến thiên chất không đồng đều sau mỗi khoảng đơn vị thời gian
=> Ta không thể tính được nồng độ các chất sau 50 giây
=> Không tính được tốc độ trung bình của phản ứng sau 50 giây
- Nồng độ biến thiên chất không đồng đều sau mỗi khoảng đơn vị thời gian
=> Ta không thể tính được nồng độ các chất sau 50 giây
=> Không tính được tốc độ trung bình của phản ứng sau 50 giây
Cho biết tốc độ phản ứng chỉ nhận giá trị dương. Giải thích vì sao phải thêm dấu trừ trong biểu thức (3) khi tính tốc độ trung bình của phản ứng theo các chất tham gia phản ứng.
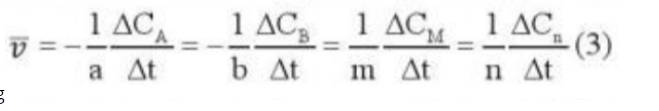
Tính tốc độ trung bình của phản ứng (4) theo O2 trong 100 giây đầu tiên.
Phản ứng A → sản phẩm được thực hiện trong bình kín. Nồng độ của A tại các thời điểm t = 0, t = 1 phút, t = 2 phút lần lượt là 0,1563M; 0,1496M; 0,1431M
a) Tính tốc độ trung bình của phản ứng trong phút thứ nhất và từ phút thứ nhất tới hết phút thứ hai.
b) Vì sao hai giá trị tốc độ tính được không bằng nhau?
Hãy sắp xếp tốc độ các phản ứng sau theo chiều tăng dần: (1) phản ứng than cháy trong không khí, (2) phàn ứng gỉ sắt, (3) phản ứng nổ của khí bình gas.
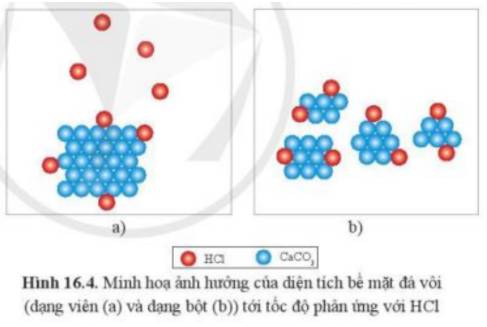
Quan sát hình 16.4, giải thích vì sao khi dùng đá vôi dạng bột thì tốc độ phản ứng nhanh hơn.
Với phản ứng có γ = 2, nếu nhiệt độ tăng từ 20oC lên 50oC thì tốc độ phản ứng tăng bao nhiêu lần?
Tốc độ của phản ứng (1) ở dung dịch HCl 2M là nhanh hơn hay chậm hơn so với ở dung dịch HCl 0,5M?
Cùng một lượng kim loại Zn phản ứng với cùng một thể tích dung dịch H2SO4 1M, nhưng ở hai nhiệt độ khác nhau.
Zn + H2SO4 → ZnSO4 + H2

Thể tích khí H2 sinh ra ở mỗi thí nghiệm theo thời gian được biểu diễn ở đồ thị bên
a) Giải thích vì sao đồ thị màu đỏ ban đầu cao hơn đồ thị màu xanh
b) Vì sao sau một thời gian, hai đường đồ thị lại chụm lại với nhau?
Trong phản ứng (6), nếu nồng độ của H2 tăng gấp đôi thì tốc độ phản ứng thay đổi như thế nào?
H2(g) + I2(g) → 2HI(g)