- Xét biểu thức
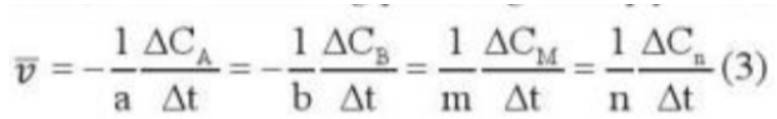
- Sau thời gian phản ứng, nồng độ chất tham gia giảm
=> Csau < Ctrước
=> ∆C < 0
- Trong khi đó: ∆t = tsau - ttrước
=> ∆t > 0
=> Phải thêm dấu trừ trong biểu thức (3) đối với chất tham gia phản ứng để tốc độ phản ứng có giá trị dương
- Xét biểu thức
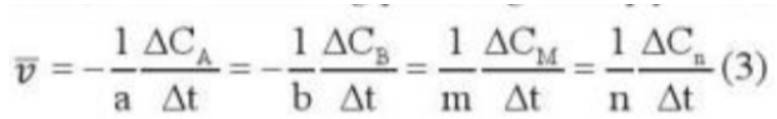
- Sau thời gian phản ứng, nồng độ chất tham gia giảm
=> Csau < Ctrước
=> ∆C < 0
- Trong khi đó: ∆t = tsau - ttrước
=> ∆t > 0
=> Phải thêm dấu trừ trong biểu thức (3) đối với chất tham gia phản ứng để tốc độ phản ứng có giá trị dương
Hãy sắp xếp tốc độ các phản ứng sau theo chiều tăng dần: (1) phản ứng than cháy trong không khí, (2) phàn ứng gỉ sắt, (3) phản ứng nổ của khí bình gas.
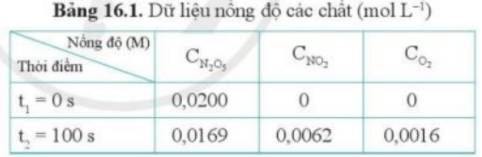
Tính tốc độ trung bình của phản ứng (4) theo O2 trong 100 giây đầu tiên.
Từ Bảng 16.1, có thể tính được tốc độ trung bình của phản ứng sau 50 giây hay không? Vì sao?
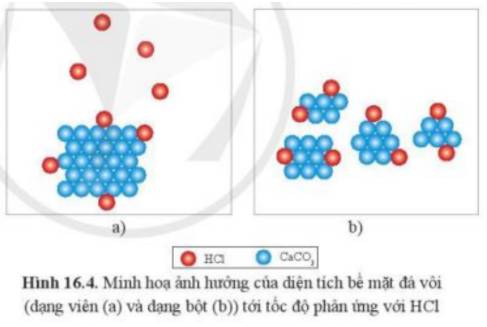
Quan sát hình 16.4, giải thích vì sao khi dùng đá vôi dạng bột thì tốc độ phản ứng nhanh hơn.
Phản ứng A → sản phẩm được thực hiện trong bình kín. Nồng độ của A tại các thời điểm t = 0, t = 1 phút, t = 2 phút lần lượt là 0,1563M; 0,1496M; 0,1431M
a) Tính tốc độ trung bình của phản ứng trong phút thứ nhất và từ phút thứ nhất tới hết phút thứ hai.
b) Vì sao hai giá trị tốc độ tính được không bằng nhau?
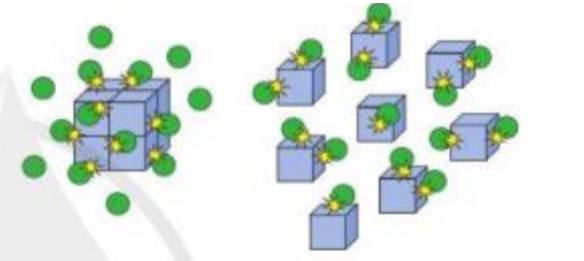
Hình ảnh bên minh họa ảnh hưởng của yếu tố nào tới tốc độ phản ứng? Giải thích.
Trong phản ứng (6), nếu nồng độ của H2 tăng gấp đôi thì tốc độ phản ứng thay đổi như thế nào?
H2(g) + I2(g) → 2HI(g)
Thực phẩm bị ôi thiu do các phản ứng oxi hóa của oxygen cũng như sự hoạt động của vi khuẩn. Giải thích vì sao để hạn chế sự ôi thiu, người ta lại bơm N2 hoặc CO2 vào túi đựng thực phẩm trước khi đóng gói. Biết rằng nồng độ oxygen trong túi thực phẩm sau khi bơm N2 hoặc CO2 chỉ còn khoảng 2 – 5%.
Với phản ứng có γ = 2, nếu nhiệt độ tăng từ 20oC lên 50oC thì tốc độ phản ứng tăng bao nhiêu lần?