Trong phản ứng (6), nếu nồng độ của H2 tăng gấp đôi thì tốc độ phản ứng thay đổi như thế nào?
H2(g) + I2(g) → 2HI(g)
Trong phản ứng (6), nếu nồng độ của H2 tăng gấp đôi thì tốc độ phản ứng thay đổi như thế nào?
H2(g) + I2(g) → 2HI(g)
Khi nồng độ của H2(g) cũng như I2(g) đều tăng lên gấp đôi thì tốc độ phản ứng của H2(g) với I2(g) tăng lên mấy lần?
Thảo luận (1)Hướng dẫn giảiÁp dụng định luật tác dụng khối lượng: v = kCH2.CI2
=> Ở một nhiệt độ không đổi, tốc độ phản ứng (6) tỉ lệ thuận với nồng độ của H2 cũng như nồng độ của I2
=> Nếu nồng độ của H2 và I2 tăng gấp đôi thì tốc độ phản ứng (6) tăng lên 4 lần
(Trả lời bởi Hà Quang Minh)
Hãy giải thích các hiện tượng dưới đây.
a) Khi ở nơi đông người trong một không gian kín, ta cảm thấy khó thở và phải thở nhanh hơn
b) Tàn đóm đỏ bùng lên khi cho vào bình oxygen nguyên chất
c) Bệnh nhân suy hô hấp cần thở oxygen thay vì không khí (chứa 21% thể tích oxygen)
Thảo luận (1)Hướng dẫn giảia) Ở nơi đông người, nồng độ oxygen giảm đi nhiều để cung cấp cho con người
=> Lượng oxygen bị hao hụt và loãng
=> Con người bị thiếu oxygen nên cảm thấy khó thở và phải thở nhanh hơn để lấy oxygen
b) Khi cho tàn đóm vào bình oxygen nguyên chất
=> Nồng độ oxygen tăng cao (vì oxygen nguyên chất có nồng độ cao hơn nhiều so với oxygen trong không khí)
=> Giúp cho phản ứng xảy ra nhanh và mạnh hơn
=> Tàn đón đỏ bùng cháy
c)
- Khi con người bị suy hô hấp => Tốc độ hô hấp giảm => Không cung cấp đủ khí oxygen cho con người
- Áp dụng định luật tác dụng khối lượng => Cần phải tăng nồng độ của chất tham gia (khí oxygen) để tăng tốc độ hô hấp
=> Bệnh nhân cần phải thở oxygen (nồng độ 100%) thay vì không khí (nồng độ oxygen 21%)
(Trả lời bởi Hà Quang Minh)
Chuẩn bị hai mẩu nhỏ đá vôi A và B có khối lượng xấp xỉ bằng nhau, trong đó mẩu B đã được tán nhỏ thành bột. Cho hai mẫu này riêng rẽ vào hai ống nghiệm chứa cùng một thể tích dung dịch HCl 0,5M. Quan sát hiện tượng để rút ra kết luận về ảnh hưởng của diện tích bề mặt tới tốc độ phản ứng.
Thảo luận (1)Hướng dẫn giải- Ta có phương trình: 2HCl + CaCO3 → CaCl2 + CO2↑ + H2O
=> Khi cho mẩu đá vôi tác dụng với dung dịch HCl thì có khí không màu thoát ra, khí đó là carbon dioxide
- Diện tích bề mặt càng lớn, tốc độ phản ứng càng lớn
(Trả lời bởi Hà Quang Minh)
Quan sát hình 16.4, giải thích vì sao khi dùng đá vôi dạng bột thì tốc độ phản ứng nhanh hơn.
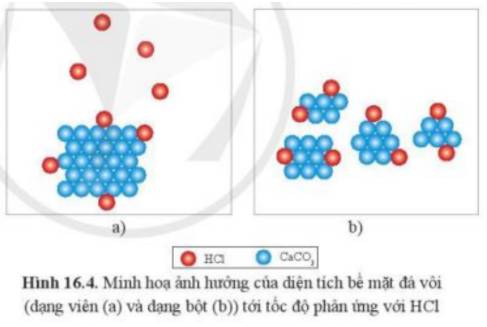
Thảo luận (1)Hướng dẫn giảiĐể phản ứng xảy ra, cần phải có sự tiếp xúc giữa HCl và CaCO3. Ở dạng bột, các phân tử CaCO3 tiếp xúc nhiều với các phân tử HCl hơn là CaCO3 ở dạng hạt
=> Tốc độ phản ứng ở dạng bột sẽ nhanh hơn
(Trả lời bởi Hà Quang Minh)
Giải thích vì sao thanh củi chẻ nhỏ hơn thì sẽ cháy nhanh hơn.
Thảo luận (1)Hướng dẫn giải- Khi chẻ nhỏ thanh củi làm tăng diện tích tiếp xúc giữa thanh củi và oxygen
- Khí oxygen giúp duy trì sự cháy, làm sự cháy diễn ra mãnh liệt
=>Thanh củi chẻ nhỏ hơn thì sẽ cháy nhanh hơn
(Trả lời bởi Hà Quang Minh)
Cho hai đinh sắt tương tự nhau (tẩy sạch gỉ và dầu mỡ) vào hai ống nghiệm chứa cùng một thể tích dung dịch HCl 1M. Một ống nghiệm để ở nhiệt độ phòng, một ống nghiệm được đun nóng bằng đèn cồn. Quan sát hiện tượng để rút ra kết luận về ảnh hưởng của nhiệt độ tới tốc độ phản ứng.
Thảo luận (1)Hướng dẫn giải- Ta có phương trình: 2HCl + Fe → FeCl2 + H2↑
=> Khi cho đinh sắt tác dụng với dung dịch HCl thì có khí không màu thoát ra, khí đó là hydrogen
- Nhiệt độ càng cao, tốc độ phản ứng càng lớn
(Trả lời bởi Hà Quang Minh)
Viết phương trình hóa học xảy ra trong thí nghiệm cho đinh sắt vào dung dịch HCl.
Thảo luận (1)Hướng dẫn giải2HCl + Fe → FeCl2 + H2↑
(Trả lời bởi Hà Quang Minh)
Với phản ứng có γ = 2, nếu nhiệt độ tăng từ 20oC lên 50oC thì tốc độ phản ứng tăng bao nhiêu lần?
Thảo luận (1)Hướng dẫn giải
Rót khoảng 2 mL nước oxi già (dung dịch H2O2 3%) vào một ống nghiệm. Quan sát hiện tượng xảy ra. Tiếp theo thêm một lượng nhỏ bột MnO2 (màu đen, dùng làm chất xúc tác) vào ống nghiệm. Quan sát hiện tượng và rút ra kết luận về ảnh hưởng của chất xúc tác tới tốc độ phản ứng.
Thảo luận (1)Hướng dẫn giải- Ta có phương trình: 2H2O2 → 2H2O + O2↑
=> Dung dịch H2O2 3% ở điều kiện thường phân hủy chậm và có khí không màu thoát ra, khí đó là Oxygen
- Khi có chất xúc tác, khí thoát ra nhiều hơn
=> Chất xúc tác MnO2 làm tăng tốc độ phân hủy H2O2
(Trả lời bởi Hà Quang Minh)