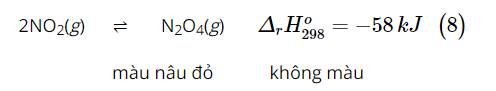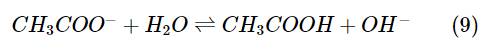Hai acid HA và HB cùng nồng độ ban đầu là 0,5 M, phân li trong nước theo các cân bằng:
HA ⇌ H+ + A-
HB ⇌ H+ + B-
Với các hằng số cân bằng (hay gọi là hằng số phân li acid) tương ứng là KC(HA) = 0,2 và KC(HB) = 0,1. Tính nồng độ H+ của mỗi dung dịch acid. Rút ra kết luận về mối liên hệ giữa độ mạnh của acid với độ lớn của hằng số phân li acid. Biết rằng acid càng mạnh khi càng dễ tạo ra H+.