Phản ứng : 2KOH + (NH4)2SO4 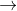 2NH3 + 2H2O + K2SO4
2NH3 + 2H2O + K2SO4
=> n NH3 = 2nmuối amoni = 0,1 mol
=>V = 2,24 l
Phản ứng : 2KOH + (NH4)2SO4 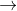 2NH3 + 2H2O + K2SO4
2NH3 + 2H2O + K2SO4
=> n NH3 = 2nmuối amoni = 0,1 mol
=>V = 2,24 l
Cho dung dịch NaOH dư vào 150 ml dung dịch (NH4)2SO4 1M.Đun nóng nhẹ,thể tích khí thu được (đktc) là
Dung dịch A chỉ chứa các ion Cu(2+), Mg(2+), NH4(+), SO4(2-), NO3(-) trong nước. Thực hiện hai thí nghiệm:
- Dẫn khí NH3 dư vào dd A, kết thúc các phản ứng thu được 0,87 gam kết tủa.
- Cho lượng dư dd Ba(OH)2 vào A thu được 0,448 lít khí (đktc) và tách ra 6,51 gam kết tủa. Lọc tách kết tủa, đem nung đến khối lượng không đổi thu được 6,06 gam chất rắn.
Số mol mỗi ion trong dung dịch A?
Hòa tan 1,20 gam kim loại X vào dung dịch HNO3dư thu được 0,22 lít khí nitơ ở đktc(giả thiết phản ứng chỉ tạo ra khí N2). Công thức của X là
Hòa tan m gam Cu vào dung dịch HNO3 dư. Sau phản ứng thu được 3,36 lít khí NO (đktc) . Gía trị của m là
Hòa tan 24,8g hỗn hợp A gồm Fe và Cu trong dung dịch HNO3 dư thu được 6,72 lít No (đktc) . Khối lượng muối tạo thành là bao nhiêu gam phần trăm mỗi kim loại trong hỗn hợp a?
Phân biệt các dung dịch mất nhãn:
a) NH3 , (NH4)3PO4, NH4NO3, NAOH
b) NH4, (NH4)2SO4, NH4CL, NH4NO3
c) NACL, NA3PO4, NANO3, NAF
Khi cho hợp chất ion A tác dụng với nước thu được dung dịch B có tính kiềm và tính oxi hóa mạnh, cho dung dịch B tác dụng với dung dịch Zn(NO3)2 và NH4NO3 sau phản ứng thu được chất kết tủa keo, sau đó kết tủa keo tan dần và một chất khí không màu bị hóa nâu trong không khí. Viết các phương trình phản ứng để giải thích các hiện tượng trên
Biết A là K2S
Cho 0,64g Cu tác dụng với axit HNO3 đặc, dư. Thể tích khí NO2 (đktc) thu được sau phản ứng là
Cho 1,32g (NH4)2SO4 tác dụng với dd NaOH dư, đun nóng thu được 1 sản phẩm khí. Hấp thụ hoàn toàn lượng khí trên vào dd chứa 3,92g H3PO4. Muối thu được