Câu hỏi: Xét phản ứng thuận nghịch: H2(g) + I2(g) ⇌ 2HI(g).
Số liệu về sự thay đổi số mol các chất trong bình phản ứng ở thí nghiệm 1 được trình bày trong Bảng 1.1 dưới đây:
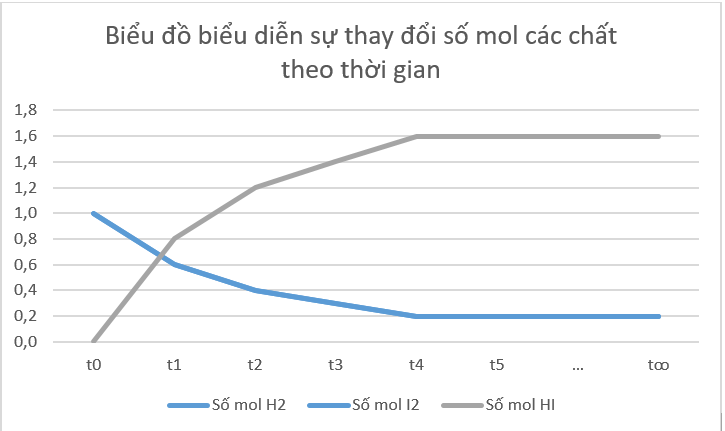
a) Vẽ đồ thị biểu diễn sự thay đổi số mol các chất theo thời gian.
b) Từ đồ thị, nhận xét về sự thay đổi số mol của các chất theo thời gian.
c) Viết biểu thức định luật tác dụng khối lượng đối với phản ứng thuận và phản ứng nghịch, từ đó dự đoán sự thay đổi tốc độ của mỗi phản ứng theo thời gian (biết các phản ứng này đều là phản ứng đơn giản).
d) Bắt đầu từ thời điểm nào thì số mol các chất trong hệ phản ứng không thay đổi nữa?
b) Từ đồ thị ta thấy: Lúc đầu số mol sản phẩm bằng 0, theo thời gian, số mol chất tham gia (hydrogen, iodine) giảm dần, số mol chất sản phẩm (hydrogen iodide) tăng dần, đến khi số mol của các chất hydrogen, iodine, hydrogen iodide không thay đổi nữa.
c) Biểu thức định luật tác dụng khối lượng:
- Đối với phản ứng thuận:
vthuận = \({\rm{k}}{\rm{.}}{{\rm{C}}_{{{\rm{H}}_{\rm{2}}}}}{\rm{.}}{{\rm{C}}_{{{\rm{I}}_{\rm{2}}}}}\)
- Đối với phản ứng nghịch:
vnghịch = \({\rm{k'}}{\rm{.C}}_{{\rm{HI}}}^2\)
Dự đoán:
- Ban đầu tốc độ phản ứng thuận giảm dần, sau một thời gian tốc độ phản ứng thuận không thay đổi theo thời gian.
- Ban đầu tốc độ phản ứng nghịch tăng dần, sau một thời gian tốc độ phản ứng nghịch không thay đổi theo thời gian.
d) Tại thời điểm phản ứng thuận nghịch đạt tới trạng thái cân bằng, tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch thì số mol các chất trong hệ phản ứng không thay đổi nữa.