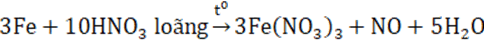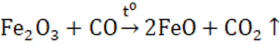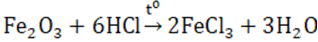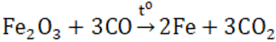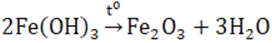Đây là phiên bản do Thảo Phương
đóng góp và sửa đổi vào 26 tháng 6 2021 lúc 21:41. Xem phiên bản hiện hành
Bài 32: Hợp chất sắt
Nội dung lý thuyết
Các phiên bản khác
0
2 gp
Bài 32: Hợp chất của sắt
I. SẮT (II)
1. Oxit FeO
- Là chất rắn, đen, không tan trong nước.
- FeO tác dụng với dung dịch HNO3 được muối sắt (III).
- Phương trình ion rút gọn như sau:
3FeO + NO3- + 10H+ → 3Fe3+ + NO + 5H2O
Điều chế: dùng H hay CO khử sắt (III) oxit ở 5000C:
2. Hidroxit Fe(OH)2
Tác dụng với dung dịch kiềm tạo kết tủa màu trắng hơi xanh, rồi hóa nâu đỏ.
Fe2+ + 2OH- → Fe(OH)2↓ (trắng xanh)
Chú ý: Muốn có Fe(OH)2 tinh khiết phải điều chế trong điều kiện không có không khí.
3. Muối sắt (II)
Muối sắt (II) dễ bị oxi hóa thành muối sắt (III) bởi các chất oxi hóa.
FeCl2 + Cl2 → 2FeCl3
Điều chế: cho Fe (hoặc FeO, Fe(OH)2) tác dụng với HCl hoặc H2SO4 loãng:
Fe + 2HCl → FeCl2 + H2
FeO + H2SO4 → FeSO4 + H2
Chú ý: dung dịch muối sắt (II) điều chế được cần dùng ngay, vì trong không khí muối sắt (II) sẽ chuyển dần thành muối sắt (III).
II. SẮT (III)
1. Oxit Fe2O3
- Sắt (III) oxit là bazơ nên dễ tan trong các dung dịch axit mạnh.
Ở nhiệt độ cao, Fe2O3 bị CO khử hoặc H2 khử thành Fe.
Điều chế: phân hủy Fe(OH)3 ở nhiệt độ cao.
2. Hidroxit Fe(OH)3
Fe(OH)3 không tan trong nước nhưng dễ tan trong dung dịch axit.
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
Điều chế: cho dung dịch kiềm tác dụng với muối sắt (III).
FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
3. Muối sắt (III)
Các muối sắt (III) có tính oxi hóa, dễ bị khử thành muối sắt (II).
Fe + 2FeCl3 → 3FeCl2
Bột đồng tan trong dung dịch muối sắt (III).
Cu + 2FeCl3 (vàng nâu) → CuCl2 + FeCl2
⇒ Dung dịch CuCl2 (màu xanh) và dung dịch FeCl2 (không màu) nên dung dịch thu được có màu xanh.
TRẮC NGHIỆM :
Câu 1: Chất nào sau đây khí phản ứng với dung dịch HNO3 đặc nóng sẽ không sinh ra khí ?
A. FeO B. Fe3O4 C. Fe2O3 D. Fe(OH)2
Câu 2: Cách nào sau đây có thể dùng để điều chế FeO ?
A. Dùng CO khử Fe2O3 ở 500°C.
B. Nhiệt phân Fe(OH)2 trong không khí.
C. Nhiệt phân Fe(NO3)2
D. Đốt cháy FeS trong oxi.
Câu 3: Hòa tan một lượng FexOy bằng H2SO4 loãng dư được dung dịch X. Biết X vừa có khả năng làm mất màu dung dịch thuốc tím, vừa có khả năng hòa tan được bột Cu. Oxit sắt đó là:
A. FeO B. Fe2O3 C. Fe3O4 D. A hoặc B
Câu 4: Dung dịch muối nào sau đây sẽ có phản ứng với dung dịch HCl khi đun nóng?
A. FeBr2 B. FeSO4 C. Fe(NO3)2 D. Fe(NO3)3
Câu 5: Dung dịch loãng chứa hỗn hợp 0,01 mol Fe(NO3)3 và 0,15 mol HCl có khả năng hòa tan tối đa lượng Fe là:
A. 0,28 gam B. 1,68 gam C. 4,20 gam D. 3,64 gam
Câu 6: Hòa tan hết m gam Fe bằng 400ml dung dịch HNO3 1M. Sau khi phản ứng xảy ra hoàn toàn, thu được dung dịch chứa 26,44 gam chất tan và khí NO (sản phẩm khử duy nhất). Giá trị của m là:
A. 7,84 B. 6,12 C. 5,60 D. 12,24
Câu 7: Cho 5,8 gam FeCO3 tác dụng với dung dịch HNO3 vừa đủ, thu được dung dịch X và hỗn hợp khí gồm CO2, NO. Cho dung dịch HCl dư vào dung dịch X được dung dịch Y, dung dịch Y hòa tan tối đa m gam Cu, sinh ra sản phẩm khử NO duy nhất. Giá trị của m là:
A. 9,6 B. 11,2 C. 14,4 D. 16
Câu 8: Đốt 5,6 gam Fe trong V lít khí Cl2 (đktc), thu được hỗn hợp X. Cho X vào dung dịch AgNO3 dư, thu được 39,5 gam kết tủa. giá trị của V là:
A. 3,36 B. 2,24 C. 2,80 D. 1,68
Câu 9: Hoà tan hoàn toàn m (g) FexOy bằng dd H2SO4 đặc nóng thu được 2,24lit SO2 (đktc). Phần dd chứa 120(g) một loại muối sắt duy nhất. Công thức oxit sắt và khối lượng m là:
A. Fe3O4; m = 23,2(g).
B. FeO, m = 32(g).
C. FeO; m = 7,2(g).
D. Fe3O4; m = 46,4(g)
Câu 10: Hòa tan hoàn toàn 2,8 gam hỗn hợp FeO , Fe2O3 và Fe3O4 cần vừa đủ V ml dung dịch HCl 1M , thu được dung dịch X. Cho từ từ dung dịch NaOH dư vào dung dịch X thu được kết tủa Y. Nung Y trong không khí đến khối lượng không đổi thu được 3 gam chất rắn. Tính V ?
A. 87,5ml B. 125ml
C. 62,5ml D. 175ml
Câu 11: Hòa tan hoàn toàn x mol CuFeS2 bằng dung dịch HNO3 đặc, nóng (dư) sinh ra y mol NO2 (sảm phẩm khử duy nhất). Liên hệ đúng giữa x và y là:
A. y = 17x B. x = 15y
C. x = 17y D. y = 15x
Câu 12: Cho hỗn hợp gồm 2,8g Fe và 3,2g Cu vào dung dịch HNO3 thu được dung dịch A, V lit khí NO2 ở đktc (sản phẩm khử duy nhất) và còn dư 1,6g kim loại. Biết các phản ứng xảy ra hoàn toàn. Khối lượng muối thu được khi cô cạn dung dịch A và giá trị của V là:
A. 10,6g và 2,24 lit.
B. 14,58g và 3,36 lit
C. 16.80g và 4,48 lit.
D. 13,7g và 3,36 lit
Câu 13: Hòa tan hết 4 gam hỗn hợp A gồm Fe và 1 oxit sắt trong dung dịch axit HCl (dư) thu được dung dịch X. Sục khí Cl2 cho đến dư vào X thu được dung dịch Y chứa 9,75 gam muối tan. Nếu cho 4 gam A tác dụng với dung dịch HNO3 loãng dư thì thu được V lít NO (sản phẩm khử duy nhất, đktc). Tính V ?
A. 0,896 B. 0,726
C. 0,747 D. 1,120
Câu 14: Dung dịch A gồm 0,4 mol HCl và 0,05 mol Cu(NO3)2. Cho m gam bột Fe vào dung dịch, khuấy đều cho đến khi phản ứng kết thúc thu được chất rắn X gồm hai kim loại có khối lượng 0,8m gam. Giả sử sản phẩm khử HNO3 duy nhất chỉ có NO. Giá trị của m bằng:
A. 20 gam B. 30 gam
C. 40 gam D. 60 gam
Câu 15: Ion nào sau đây tác dụng với ion Fe2+ tạo thành Fe3+ ?
A. Cu2+ B. Ag+
C. Al3+ D. Zn2+
Danh sách các phiên bản khác của bài học này. Xem hướng dẫn