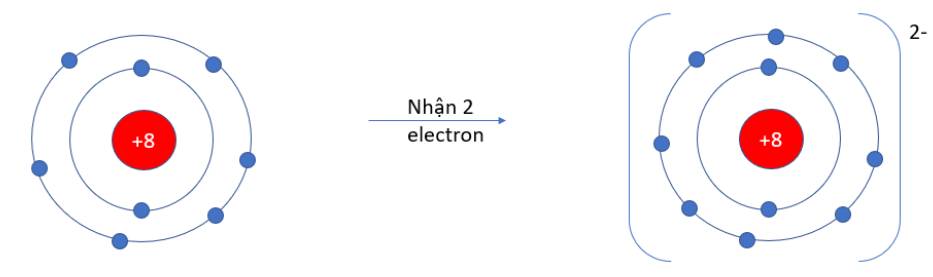
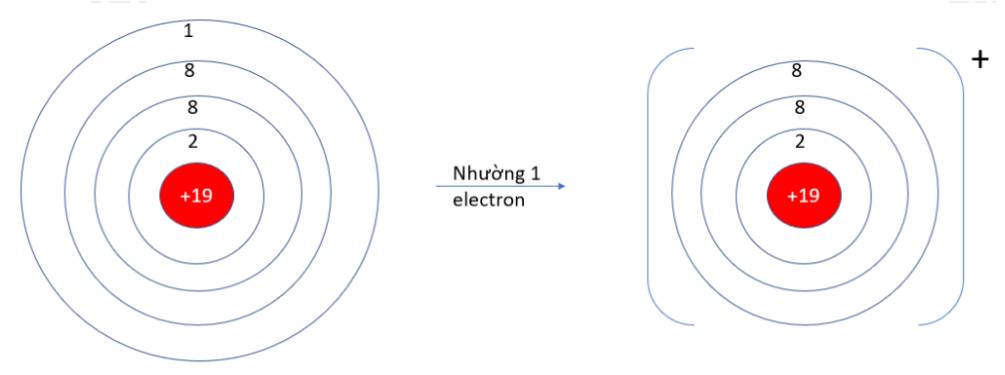
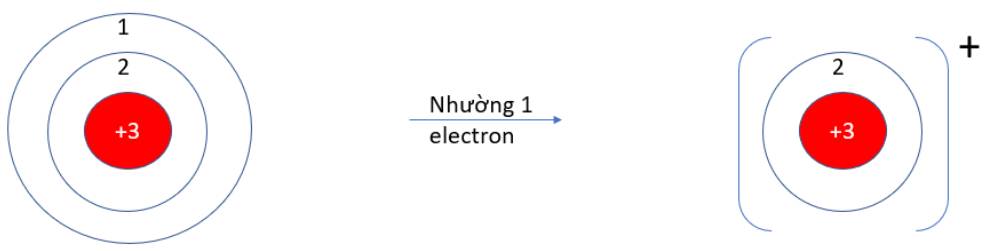
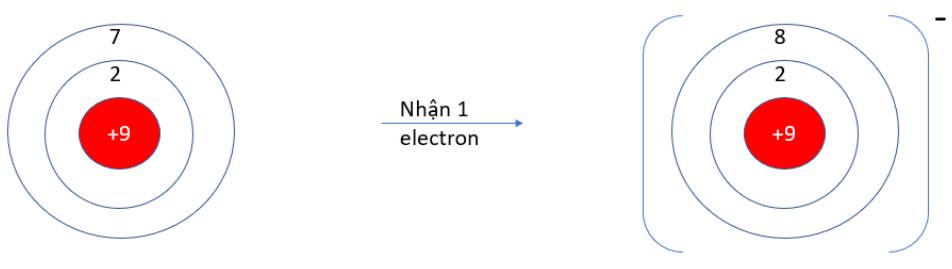
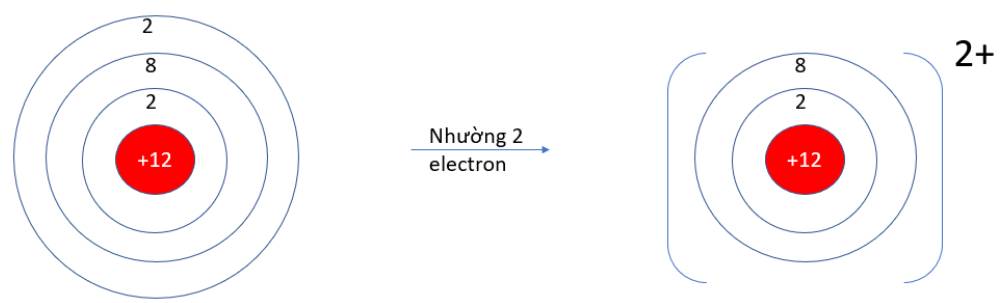
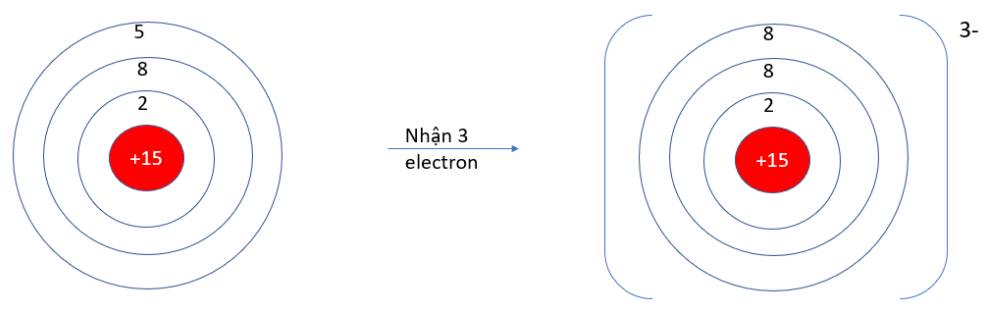
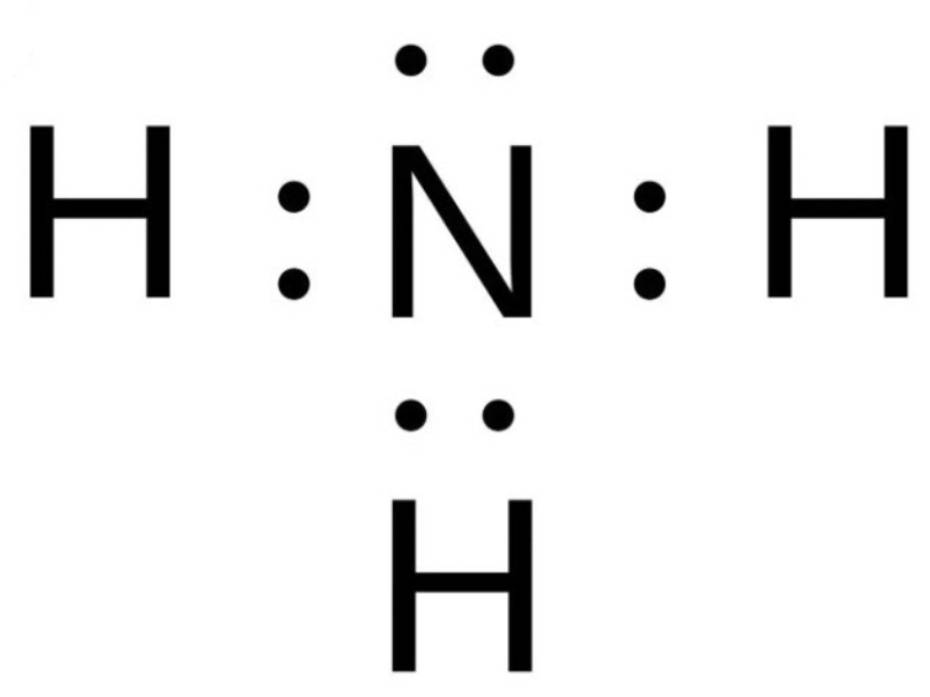
Quan sát hiện tượng tự nhiên sau:
Viên bi rơi từ trên cao (vị trí có năng lượng cao hơn) xuống dưới đất (vị trí có năng lượng thấp hơn) mà không tự lăn theo chiều ngược lại.
Hãy cho biết quá trình trên diễn ra theo xu hướng tạo nên hệ bền hơn (năng lượng thấp hơn) hay kém bền hơn (năng lượng cao hơn)