Các định luật Boyle và Charles chỉ xác định mối liên hệ giữa hai cặp thông số "áp suất - thể tích" và "thể tích - nhiệt độ" của một khối lượng khí xác định. Vậy, làm thế nào để xác định được mối liên hệ của cả ba thông số trạng thái của một khối lượng khí xác định?
Bài 11. Phương trình trạng thái của khí lí tưởng
Mở đầu (SGK Kết nối tri thức với cuộc sống trang 45)
Thảo luận (1)
Hoạt động 1 (SGK Kết nối tri thức với cuộc sống trang 45)
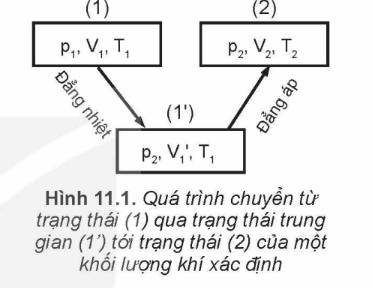
Hãy dựa vào các định luật Boyle, Charles và Hình 11.1 về quá trình chuyến trạng thái của một khối lượng khí xác định để lập phương trình dưới đây về mối liên hệ giữa ba thông số trạng thái của một khối lượng khí xác định:frac{{{p_1}{V_1}}}{{{T_1}}} frac{{{p_2}{V_2}}}{{{T_2}}} Rightarrow frac{{pV}}{T} hằng sốĐộ lớn của hăng số trên phụ thuộc vào lượng khí ta xét.
Đọc tiếp
Hãy dựa vào các định luật Boyle, Charles và Hình 11.1 về quá trình chuyến trạng thái của một khối lượng khí xác định để lập phương trình dưới đây về mối liên hệ giữa ba thông số trạng thái của một khối lượng khí xác định:
\(\frac{{{p_1}{V_1}}}{{{T_1}}} = \frac{{{p_2}{V_2}}}{{{T_2}}} \Rightarrow \frac{{pV}}{T}\)= hằng số
Độ lớn của hăng số trên phụ thuộc vào lượng khí ta xét.
Thảo luận (1)Hướng dẫn giải- Định luật Boyle:
p₁V₁ = p₂V₂ => \({V_2} = \frac{{{p_1}{V_1}}}{{{T_1}}}\) (khi T = const)
- Định luật Charles:
\(\frac{{{V_1}}}{{{T_1}}} = \frac{{{V_2}}}{{{T_2}}} \Rightarrow {V_2} = \frac{{{V_1}{T_2}}}{T}\) (khi p = const)
- Hình 11.1:
Quá trình biến đổi trạng thái từ (p₁, V₁, T₁) đến (p₂, V₂, T₂).
\( \Rightarrow \frac{{{p_1}{V_1}}}{{{p_2}}} = \frac{{{V_1}{T_2}}}{{{T_1}}} \Rightarrow \frac{{{p_1}{V_1}}}{{{T_1}}} = \frac{{{p_2}{V_2}}}{{{T_2}}}\)
(Trả lời bởi Hà Quang Minh)
Câu hỏi 1 (SGK Kết nối tri thức với cuộc sống trang 45)
Hãy lập phương trình \(\frac{{{p_1}{V_1}}}{{{T_1}}} = \frac{{{p_2}{V_2}}}{{{T_2}}}\) bằng một cách biến đổi trạng thái khác cách trong Hình 11.1 để chứng tỏ: Quá trình chuyển trạng thái không phụ thuộc cách chuyển trạng thái mà chỉ phụ thuộc trạng thái đầu và trạng thái cuối.
Thảo luận (1)Hướng dẫn giảiLập phương trình chứng tỏ quá trình chuyển trạng thái không phụ thuộc cách chuyển trạng thái:
- Cách biến đổi trạng thái khác trong Hình 11.1:
+ Chọn trạng thái trung gian (1') với áp suất p' và thể tích V₂.
+ Áp dụng định luật Boyle cho quá trình đẳng nhiệt (1) → (1'): p₁V₁ = p'V₂
+ Áp dụng định luật Charles cho quá trình đẳng áp (1') → (2): V₂/T₁ = V₂/T₂
Thay V₂ từ hai phương trình trên vào nhau:
\( \Rightarrow \frac{{{p_1}{V_1}}}{{p'}} = \frac{{{V_2}}}{{{T_2}}} \Rightarrow {p_1}{T_1} = p'{T_2} = const\)
So sánh với phương trình (11.1):
\(\frac{{{p_1}{T_1}}}{{{p_2}{T_2}}} = const\)
Ta thấy hai phương trình có dạng tương tự nhau, chỉ khác nhau ở ký hiệu áp suất (p' thay cho p₂).
(Trả lời bởi Hà Quang Minh)
Câu hỏi 2 (SGK Kết nối tri thức với cuộc sống trang 45)
Tại sao không gọi phương trình (11.1) là phương trình trạng thái của chất khí mà lại gọi là phương trình trạng thái của khí lí tưởng?
Thảo luận (1)Hướng dẫn giảiLý do không gọi phương trình (11.1) là phương trình trạng thái của chất khí:
- Phương trình (11.1): \(\frac{{{p_1}{T_1}}}{{{p_2}{T_2}}} = const\)
- Lý do không gọi phương trình (11.1) là phương trình trạng thái của chất khí:
+ Phương trình (11.1) chỉ áp dụng cho khí lí tưởng.
+ Khí lí tưởng là khí giả định, có các tính chất: Các phân tử khí có kích thước bằng 0. Lực tương tác giữa các phân tử khí bằng 0. Các phân tử khí chuyển động hỗn loạn, va chạm hoàn toàn đàn hồi.
+ Trên thực tế, không có khí nào hoàn toàn là khí lí tưởng.
+ Các khí thực đều có: Kích thước phân tử. Lực tương tác giữa các phân tử.
Do đó, phương trình (11.1) chỉ là phương trình trạng thái gần đúng của chất khí.
(Trả lời bởi Hà Quang Minh)
Hoạt động 2.1 (SGK Kết nối tri thức với cuộc sống trang 45)
Hãy biểu diễn bằng đồ thị trong hệ toạ độ (p - V) các quá trình chuyển trạng thái vẽ ở Hình 11.1.
Hoạt động 2.2 (SGK Kết nối tri thức với cuộc sống trang 45)
Từ phương trình trạng thái của khí lí tưởng suy ra hệ thức liên hệ giữa áp suất và nhiệt độ tuyệt đối trong quá trình đẳng tích.
Thảo luận (1)Hướng dẫn giảipV = nRT
Quá trình đẳng tích: Thể tích khí không đổi (V = const)
\( \Rightarrow p = \frac{{nRT}}{V} \Rightarrow \frac{p}{T} = const\)
(Trả lời bởi Hà Quang Minh)
Hoạt động 1 (SGK Kết nối tri thức với cuộc sống trang 47)
Bóng thám không. Bóng thám không được sử dụng để thu thập thông tin về môi trường không khí và thời tiết. Bóng thường được bơm khí hiếm nhẹ hơn không khí, nhờ đó có thể bay lên các tầng không khí khác nhau để thu thập thông tin về nhiệt độ, độ ẩm, áp suất, tốc độ gió,...Người ta muốn chế tạo một bóng thám không có thể tăng bán kính lên tới 10 m khi bay ở tầng khí quyển có áp suất 0,3.105 Pa và nhiệt độ 200 K. Hỏi bán kính của bóng khi vừa bơm xong phải bằng bao nhiêu? Biết bóng được bơm ở áp suấ...
Đọc tiếp
Bóng thám không. Bóng thám không được sử dụng để thu thập thông tin về môi trường không khí và thời tiết. Bóng thường được bơm khí hiếm nhẹ hơn không khí, nhờ đó có thể bay lên các tầng không khí khác nhau để thu thập thông tin về nhiệt độ, độ ẩm, áp suất, tốc độ gió,...
Người ta muốn chế tạo một bóng thám không có thể tăng bán kính lên tới 10 m khi bay ở tầng khí quyển có áp suất 0,3.105 Pa và nhiệt độ 200 K. Hỏi bán kính của bóng khi vừa bơm xong phải bằng bao nhiêu? Biết bóng được bơm ở áp suất 1,02.105 Pa và nhiệt độ 300 K.
Thảo luận (1)Hướng dẫn giải\({p_1}{V_1} = {p_2}{V_2} \Rightarrow 1,{02.10^5}V = 0,{3.10^5}V' \Rightarrow V' = 3,4V\)
\({R^3} = \frac{V}{{\frac{4}{3}\pi }} = \frac{{V'}}{{\frac{4}{3}\pi }}.\frac{1}{{3,4}} = 8,82 \Rightarrow R = 2,066m\)
(Trả lời bởi Hà Quang Minh)
Hoạt động 2 (SGK Kết nối tri thức với cuộc sống trang 47)
Túi khí. Trong ô tô, người ta thường đặt ở hệ thống tay lái một thiết bị nhằm bảo vệ người lái xe khi xe gặp tai nạn, gọi là túi khí. Túi khí được chế tạo bằng vật liệu co giãn, chịu được áp suất lớn. Trong túi khí thường chứa chất NaN3 khi xe va chạm mạnh vào vật cản thì hệ thống cảm biến của xe sẽ kích thích chất rắn này làm nó phân huy tạo thành Na và khí N2. Khí N2 được tao thành có tác dung làm phồng túi lên, giúp người lái xe không bị va chạm trực tiếp vào hệ thống lái (Hình 11.2). a) Viết...
Đọc tiếp
Túi khí. Trong ô tô, người ta thường đặt ở hệ thống tay lái một thiết bị nhằm bảo vệ người lái xe khi xe gặp tai nạn, gọi là "túi khí". Túi khí được chế tạo bằng vật liệu co giãn, chịu được áp suất lớn. Trong túi khí thường chứa chất NaN3 khi xe va chạm mạnh vào vật cản thì hệ thống cảm biến của xe sẽ kích thích chất rắn này làm nó phân huy tạo thành Na và khí N2. Khí N2 được tao thành có tác dung làm phồng túi lên, giúp người lái xe không bị va chạm trực tiếp vào hệ thống lái (Hình 11.2).
a) Viết phương trình phân hủy NaN3.
b) Tính lượng chất khí N2 được giải phóng khi xảy ra phản ứng phân hủy NaN3, biết trong túi chứa 100 g NaN3 và thể tích mol là 24,0 lít /mol.
c) Biết thể tích túi khí khi phồng lên có độ lớn tới 48 lít. Bỏ qua thể tích khí có trong túi trước khi phồng lên và thể tích của Na được tạo thành trong túi do phản ứng phân huỷ. Tính áp suất của khí N2 trong túi khí khi đã phòng lên, biết nhiệt độ là 30 °C.
Thảo luận (1)Hướng dẫn giảia) 2NaN3 → 2Na + 3N2
b) \({n_{Na{N_3}}} = \frac{m}{M} = \frac{{100}}{{65}} = 1,54mol\)
\({n_{{N_2}}} = \frac{3}{2}{n_{Na{N_3}}} = 2,31mol\)
\({V_{{N_2}}} = {n_{{N_2}}}.{V_{{N_2}}} = 2,31.24 = 55,44l\)
c)
T = 30 + 273,15 = 303,15 K
pV = nRT \( \Rightarrow p = \frac{{nRT}}{V} = \frac{{2,31.0,0821.303,15}}{{48}} = 1,27atm\)
(Trả lời bởi Hà Quang Minh)