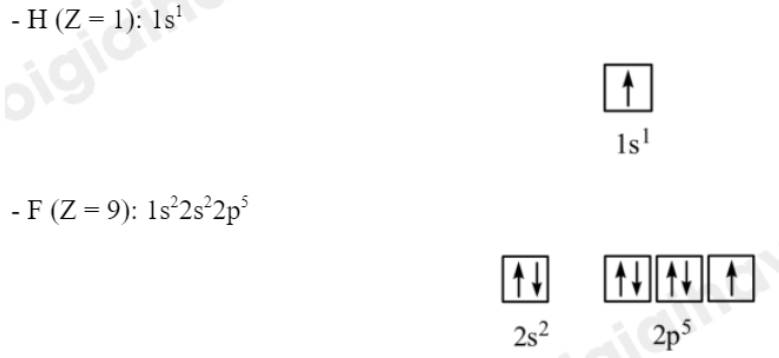
Dựa theo độ âm điện, hãy cho biết loại liên kết trong các phân tử: H2S, CH4, K2O, F2O, NaBr.
Bài 11: Liên kết cộng hoá trị
Luyện tập 3 (SGK Cánh Diều trang 60)
Thảo luận (1)
Luyện tập 4 (SGK Cánh Diều trang 61)
Viết ô orbital của lớp electron ngoài cùng cho nguyên tử H và F. Từ đó chỉ ra những AO nào có thể xen phủ tạo liên kết đơn trong các phân tử H2, F2 và HF.
Thảo luận (1)Hướng dẫn giảiTham khảo:
Bước 1: Viết cấu hình electron và ô orbital của lớp electron ngoài cùng cho nguyên tử H, F
Bước 2: Chỉ ra các AO có thể xen phủ tạo liên kết đơn trong các phân tử H2, F2, HF.
- Trong phân tử H2: 2 AO s xen phủ trục tạo liên kết đơn.
- Trong phân tử F2: 2 AO p xen phủ trục tạo liên kết đơn.
- Trong phân tử HF: 1 AO s của H và 1 AO p của F xen phủ trục tạo liên kết đơn
(Trả lời bởi Kiều Sơn Tùng)
Luyện tập 5 (SGK Cánh Diều trang 61)
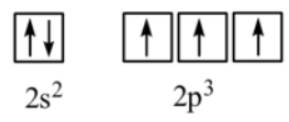
Viết ô orbital của lớp electron ngoài cùng cho nguyên tử N. Từ đó chỉ ra những AO nào có thể xen phủ tạo liên kết ba trong các phân tử N2.
Thảo luận (1)Hướng dẫn giảiBước 1: Viết cấu hình electron và ô orbital của lớp electron ngoài cùng cho nguyên tử H, F
N (Z = 7): 1s22s22p3
Bước 2: Chỉ ra các AO có thể xen phủ tạo liên kết ba trong phân tử N2.
Trong phân tử N2, liên kết ba được hình thành do:
- 2 AO p xen phủ trục tạo 1 liên kết .
- 4 AO p xen phủ bên tạo 2 liên kết .
(Trả lời bởi Hà Quang Minh)
Vận dụng (SGK Cánh Diều trang 62)
Xây dựng mô hình phân tử
Sử dụng đất sét nặn (hoặc hộp xây dựng mô hình) để tạo hình nguyên tử và các đoạn ống hút để biểu diễn liên kết hóa học. Xây dựng mô hình các phân tử: CH2 = CH2, CHCl = CHCl. Biết rằng các nguyên tử đều nằm trên cùng một mặt phẳng.
Thảo luận (1)Hướng dẫn giảiTham khảo:
Học sinh sử dụng đất sét nặn (hoặc hộp xây dựng mô hình) để tạo hình nguyên tử và các đoạn ống hút để biểu diễn liên kết hóa học, xây dựng mô hình các phân tử: CH2 = CH2, CHCl = CHCl.
(Trả lời bởi Kiều Sơn Tùng)
Luyện tập 6 (SGK Cánh Diều trang 62)
Sắp xếp năng lượng của các loại liên kết: liên kết đơn, liên kết đôi, liên kết ba của cùng một cặp nguyên tố theo chiều tăng dần. Giải thích?
Thảo luận (1)Hướng dẫn giảiTa có độ bền các liên kết của cùng một cặp nguyên tử lần lượt là: liên kết đơn < liên kết đôi < liên kết ba.
⟹ Năng lượng liên kết liên kết đơn, liên kết đôi, liên kết ba của cùng một cặp nguyên tử tăng dần.
(Trả lời bởi Hà Quang Minh)
Bài 1 (SGK Cánh Diều trang 63)
Những phát biểu nào sau đây đúng?(a) Nếu cặp electron chung bị lệch về phía một nguyên tử thì đó là liên kết cộng hóa trị không cực.(b) Nếu cặp electron chung bị lệch về phía một nguyên tử thì đó là liên kết cộng hóa trị có cực.(c) Cặp electron chung luôn được tạo nên từ 2 electron của cùng một nguyên tử.(d) Cặp electron chung được tạo nên từ 2 electron hóa trị.
Đọc tiếp
Những phát biểu nào sau đây đúng?
(a) Nếu cặp electron chung bị lệch về phía một nguyên tử thì đó là liên kết cộng hóa trị không cực.
(b) Nếu cặp electron chung bị lệch về phía một nguyên tử thì đó là liên kết cộng hóa trị có cực.
(c) Cặp electron chung luôn được tạo nên từ 2 electron của cùng một nguyên tử.
(d) Cặp electron chung được tạo nên từ 2 electron hóa trị.
Thảo luận (1)Hướng dẫn giải(a) Sai, nếu cặp electron chung bị lệch về phía một nguyên tử thì đó là liên kết cộng hóa trị có cực.
(b) Đúng.
(c) Sai, cặp electron chung được tạo nên từ 2 electron của 2 nguyên tử.
(d) Đúng, cặp electron chung được tạo nên từ 2 electron hóa trị (electron ngoài cùng là những electron ở các orbital ngoài cùng và có thể tham gia vào các liên kết của nguyên tử).
(Trả lời bởi Hà Quang Minh)
Bài 2 (SGK Cánh Diều trang 63)
Những phát biểu nào sau đây đúng?
(a) Liên kết đôi được tạo nên từ 2 liên kết $\sigma $.
(b) Liên kết ba được tạo nên từ 2 liên kết $\sigma $và 1 liên kết $\pi $.
(c) Liên kết đôi được tạo nên từ 1 liên kết $\sigma $và 1 liên kết $\pi $.
(d) Liên kết đôi được tạo nên từ 1 liên kết $\sigma $và 2 liên kết $\pi $.
Thảo luận (1)Hướng dẫn giải(a) Sai, liên kết đôi được tạo nên từ 1 liên kết $\sigma $ và 1 liên kết $\pi $.
(b) Sai, liên kết ba được tạo nên từ 1 liên kết $\sigma $và 2 liên kết $\pi $.
(c) Đúng.
(d) Sai.
(Trả lời bởi Hà Quang Minh)
Bài 3 (SGK Cánh Diều trang 63)
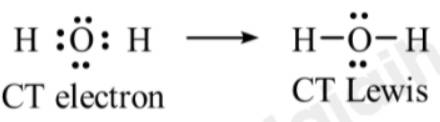
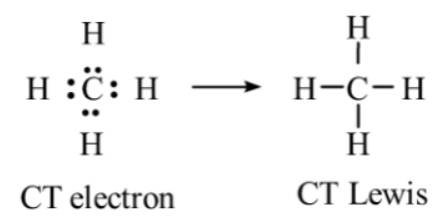
Viết công thức Lewis cho các phân tử H2O và CH4. Mỗi phân tử này có bao nhiêu cặp electron hóa trị riêng?
Thảo luận (1)Hướng dẫn giải- Phân tử H2O:
⟹ Phân tử H2O có 2 cặp electron hóa trị riêng.
- Phân tử CH4:
⟹ Phân tử CH4 không có cặp electron hóa trị riêng.
(Trả lời bởi Hà Quang Minh)
Bài 4 (SGK Cánh Diều trang 63)
Sử dụng bảng giá trị năng lượng liên kết ở Phụ lục 2.
a) Hãy tính tổng năng lượng liên kết trong mỗi phân tử H2S và H2O.
b) Nhiệt độ để bắt đầu phá vỡ liên kết (nhiệt độ phân hủy) trong hai chất trên ứng với một trong hai nhiệt độ sau: 400oC hoặc 1000oC. Em hãy dự đoán nhiệt độ phân hủy của chất nào cao hơn. Vì sao?
Thảo luận (1)Hướng dẫn giảia)
- Phân tử H2S:
+ Năng lượng liên kết của S – H là: 368 kJ mol-1.
+ Vì có 2 liên kết S – H
⟹ Tổng năng lượng liên kết trong phân tử H2S là: 368.2 = 736 (kJ mol-1)
- Phân tử H2O:
+ Năng lượng liên kết của O – H là: 464 kJ mol-1.
+ Vì có 2 liên kết O – H
⟹ Tổng năng lượng liên kết trong phân tử H2O là: 464.2 = 928 (kJ mol-1)
b)
- Ta thấy năng lượng liên kết của H2S là 38 kJ mol-1 ; của H2O là 928 kJ mol-1.
⟹ Năng lượng liên kết của H2S < H2O.
⟹ Liên kết của H2O bền hơn H2S.
⟹ Nhiệt độ phân hủy của H2O > H2S.
(Trả lời bởi Hà Quang Minh)
Bài 5* (SGK Cánh Diều trang 63)
Khi phản ứng với H2, các phân tử như F2, N2 cần phải cắt đứt liên kết giữa các nguyên tử. Dựa vào năng lượng liên kết, em hãy dự đoán phản ứng của F2 hay của N2 với H2 sẽ thuận lợi hơn (dễ xảy ra hơn)?
Thảo luận (1)Hướng dẫn giải- Giá trị năng lượng liên kết của:
+ F – F trong phân tử F2: 159 kJ mol-1
+ N = N trong phân tử N2: 418 kJ mol-1
⟹ Năng lượng liên kết của F – F < N = N.
⟹ Liên kết của N2 bền hơn F2.
- Vậy phản ứng giữa F2 với H2 thuận lợi hơn (dễ xảy ra hơn) so với phản ứng giữa N2 với H2.
(Trả lời bởi Hà Quang Minh)