Câu 1:
Hiện tượng: Khi cho kẽm vào dd HCl ta thấy kẽm tan dần, chuyển thành dung dịch mới có màu trắng, có khí không màu thoát ra (khí H2)
Câu 2: Bạn làm rồi. Mình không làm nữa nhé!
Câu 3:
- Thu khí O2: đẩy không khí (để ngửa bình) vì khí O2 nặng hơn kkhí (32>29)
- Thu khí H2: đẩy không khí (để úp bình) vì khí H2 nhẹ hơn kkhí (2<29)
- Thu khí CO2 : đẩy kkhí (để ngửa bình) vì khí CO2 nặng hơn kkhí (44>29)
Câu 4:
PTHH: Zn + H2SO4 -> ZnSO4 + H2 (1)
Ta có: \(n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\)
Theo PTHH và đề bài, ta có: \(n_{H_2}=n_{Zn}=0,3\left(mol\right)\\ n_{HCl}=2.n_{Zn}=2.0,3=0,6\left(mol\right)\)
a) Thể tích khí H2 sinh ra (đktc): \(V_{H_2}=0,3.22,4=6,72\left(l\right)\)
b) Khối lượng axit cần dùng cho phản ứng: \(m_{HCl}=0,3.36,5=21,9\left(g\right)\)
c) PTHH: 3H2 + Fe2O3 -to-> 2Fe + 3H2O (2)
Ta có: \(n_{H_2\left(2\right)}=n_{H_2\left(1\right)}=0,3\left(mol\right)\\ n_{Fe_2O_3\left(2\right)}=\dfrac{32}{160}=0,2\left(mol\right)\)
Theo PTHH và đề bài, ta có:
\(\dfrac{n_{H_2\left(đề\right)}}{n_{H_2\left(PTHH\right)}}=\dfrac{0,3}{3}< \dfrac{n_{Fe_2O_3\left(đề\right)}}{n_{Fe_2O_3\left(PTHH\right)}}=\dfrac{0,2}{1}\)
=> H2 hết, Fe2O3 dư nên tính theo \(n_{H_2}\)
Chất rắn có trong ống nghiệm khi thu được là Fe.
Ta có: \(n_{Fe}=\dfrac{2.0,3}{3}=0,2\left(mol\right)\)
Vì phản ứng có hiệu suất là 100% nên \(n_{Fe\left(líthuyết\right)}=n_{Fe\left(thựctế\right)}=0,2\left(mol\right)\)
Khối lượng chất rắn thu được:
\(m_{Fe}=0,2.56=11,2\left(g\right)\)












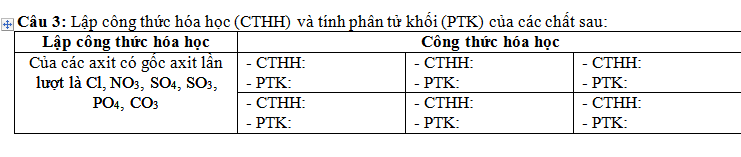






 Mn giúp em câu 5 với
Mn giúp em câu 5 với


