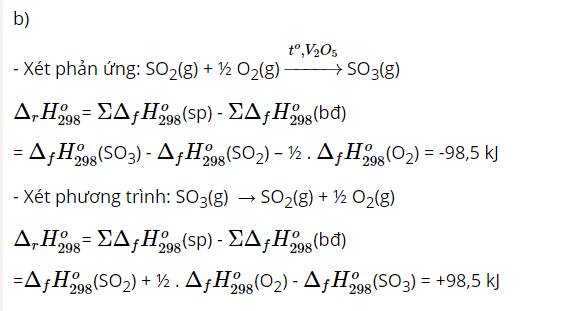Bài 14: Tính biến thiên enthalpy của phản ứng hoá học
Các câu hỏi tương tự
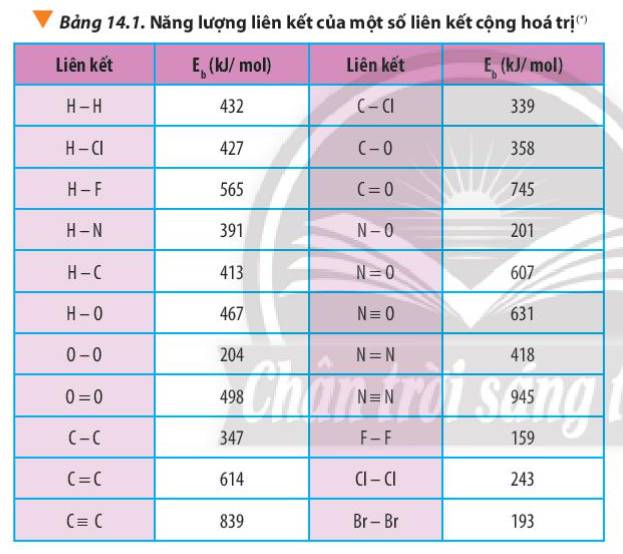
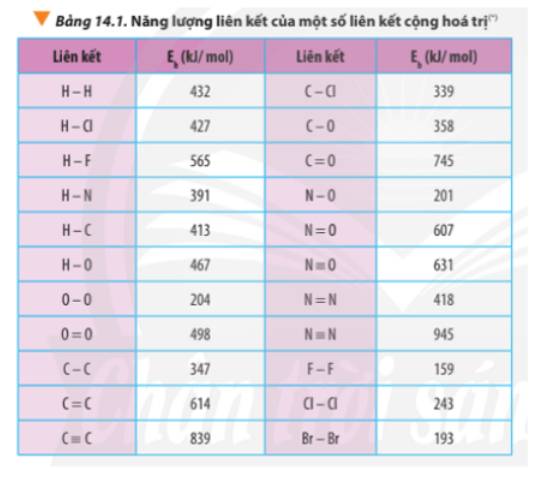
Xác định Δr\(H^0_{298}\)của phản ứng sau dựa vào giá trị Eb ở Bảng 14.1:
CH4(g) + Cl2(g) \(\underrightarrow{askt}\) CH3Cl(g) + HCl(g)
Hãy cho biết phản ứng trên tỏa nhiệt hay thu nhiệt?
Dựa vào giá trị enthalpy tạo thành ở Bảng 13.1, hãy tính giá trị Δr\(H^0_{298}\)của các phản ứng sau:
CS2(l) + 3O2(g) \(\underrightarrow{t^o}\) CO2(g) + 2SO2(g) (1)
4NH3(g) + 3O2 \(\underrightarrow{t^o}\) 2N2(g) + 6H2O(g) (2)
Tính ΔrH^0_{298} của các phản ứng sau dựa theo năng lượng liên kết (sử dụng số liệu từ Bảng 14.1):a) N2H4(g) → N2(g) + 2H2(g)b) 4HCl(g) + O2(g) underrightarrow{t^o} 2Cl2(g) + 2H2O(g)
Đọc tiếp
Tính Δr\(H^0_{298}\) của các phản ứng sau dựa theo năng lượng liên kết (sử dụng số liệu từ Bảng 14.1):
a) N2H4(g) → N2(g) + 2H2(g)
b) 4HCl(g) + O2(g) \(\underrightarrow{t^o}\) 2Cl2(g) + 2H2O(g)
Tính Δr\(H^0_{298}\)của hai phản ứng sau:
3O2(g) → 2O3(g) (1)
2O3(g) → 3O2(g) (2)
Liên hệ giữa giá trị Δr\(H^0_{298}\)với độ bền của O3, O2 và giải thích, biết phân tử O3 gồm 1 liên kết đôi O=O và 1 liên kết đơn O-O.
Khí hydrogen cháy trong không khí tạo thành nước theo phương trình hóa học sau:
2H2(g) + O2(g) → 2H2O(g) \(\Delta r,\) \(H^0_{298}\) = -483,64 kJ
a) Nước hay hỗn hợp của oxygen và hydrogen có năng lượng lớn hơn? Giải thích.
b) Vẽ sơ đồ biến thiên năng lượng của phản ứng giữa hydrogen và oxygen.
Xét quá trình đốt cháy khí propane C3H8(g):
C3H8(g) + 5O2(g) \(\underrightarrow{t^o}\) CO2(g) + 4H2O(g)
Tính biến thiên enthalpy chuẩn của phản ứng dựa vào nhiệt tạo thành của hợp chất (Bảng 13.1) và dựa vào năng lượng liên kết (Bảng 14.1). So sánh hai giá trị đó và rút ra kết luận.
Dựa vào Bảng 13.1, tính biến thiên enthalpy chuẩn của phản ứng đốt cháy hoàn toàn 1 mol benzene C6H6(l) trong khí oxygen, tạo thành CO2(g) và H2O(l). So sánh lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g propane C3H8(g) với lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g benzenne C6H6(l).
Dựa vào năng lượng liên kết ở Bảng 14.1, tính biến thiên enthalpy của phản ứng và giải thích vì sao nitrogen (N≡N) chỉ phản ứng với oxygen (OO) ở nhiệt độ cao hoặc có tia lửa điện để tạo thành nitrogen monoxide (NO).N2(g) + O2(g) underrightarrow{t^o} 2NO(g)
Đọc tiếp
Dựa vào năng lượng liên kết ở Bảng 14.1, tính biến thiên enthalpy của phản ứng và giải thích vì sao nitrogen (N≡N) chỉ phản ứng với oxygen (O=O) ở nhiệt độ cao hoặc có tia lửa điện để tạo thành nitrogen monoxide (N=O).
N2(g) + O2(g) \(\underrightarrow{t^o}\) 2NO(g)
Dựa vào enthalpy tạo thành ở Bảng 13.1, tính biến thiên enthalpy chuẩn của phản ứng nhiệt nhôm:
2Al(s) + Fe2O3(s) \(\underrightarrow{t^o}\) 2Fe(s) + Al2O3(s)
Từ kết quả tính được ở trên, hãy rút ra ý nghĩa của dấu và giá trị Δr\(H^0_{298}\) đối với phản ứng.