Bài 14: Tính biến thiên enthalpy của phản ứng hoá học
Các câu hỏi tương tự
Xét quá trình đốt cháy khí propane C3H8(g):
C3H8(g) + 5O2(g) \(\underrightarrow{t^o}\) CO2(g) + 4H2O(g)
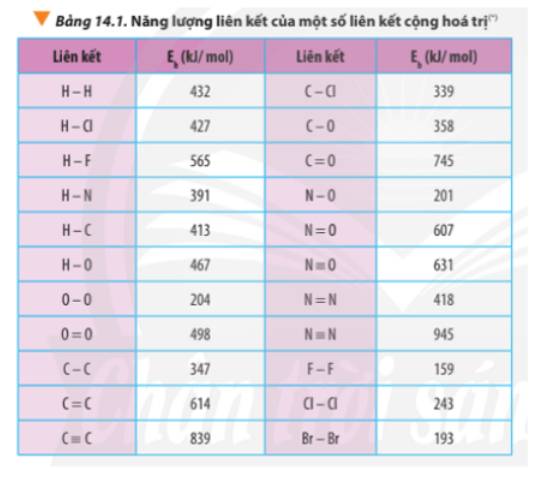
Tính biến thiên enthalpy chuẩn của phản ứng dựa vào nhiệt tạo thành của hợp chất (Bảng 13.1) và dựa vào năng lượng liên kết (Bảng 14.1). So sánh hai giá trị đó và rút ra kết luận.
Dựa vào số liệu về năng lượng liên kết ở Bảng 14.1, hãy tính biến thiên enthalpy của 2 phản ứng sau:2H2(g) + O2(g) underrightarrow{t^o} 2H2O(g) (1)C7H16(g) + 11O2(g) underrightarrow{t^o} 7CO2(g) + 8H2O(g) (2)So sánh kết quả thu được, từ đó cho biết H2 hay C7H16 là nhiên liệu hiệu quả hơn cho tên lửa (biết trong C7H16 có 6 liên kết C-C và 16 liên kết C-H)
Đọc tiếp
Dựa vào số liệu về năng lượng liên kết ở Bảng 14.1, hãy tính biến thiên enthalpy của 2 phản ứng sau:
2H2(g) + O2(g) \(\underrightarrow{t^o}\) 2H2O(g) (1)
C7H16(g) + 11O2(g) \(\underrightarrow{t^o}\) 7CO2(g) + 8H2O(g) (2)
So sánh kết quả thu được, từ đó cho biết H2 hay C7H16 là nhiên liệu hiệu quả hơn cho tên lửa (biết trong C7H16 có 6 liên kết C-C và 16 liên kết C-H)

Dựa vào Bảng 13.1, tính biến thiên enthalpy chuẩn của phản ứng đốt cháy hoàn toàn 1 mol benzene C6H6(l) trong khí oxygen, tạo thành CO2(g) và H2O(l). So sánh lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g propane C3H8(g) với lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g benzenne C6H6(l).
Dựa vào enthalpy tạo thành ở Bảng 13.1, tính biến thiên enthalpy chuẩn của phản ứng nhiệt nhôm:
2Al(s) + Fe2O3(s) \(\underrightarrow{t^o}\) 2Fe(s) + Al2O3(s)
Từ kết quả tính được ở trên, hãy rút ra ý nghĩa của dấu và giá trị Δr\(H^0_{298}\) đối với phản ứng.
Tính ΔrH^0_{298} của các phản ứng sau dựa theo năng lượng liên kết (sử dụng số liệu từ Bảng 14.1):a) N2H4(g) → N2(g) + 2H2(g)b) 4HCl(g) + O2(g) underrightarrow{t^o} 2Cl2(g) + 2H2O(g)
Đọc tiếp
Tính Δr\(H^0_{298}\) của các phản ứng sau dựa theo năng lượng liên kết (sử dụng số liệu từ Bảng 14.1):
a) N2H4(g) → N2(g) + 2H2(g)
b) 4HCl(g) + O2(g) \(\underrightarrow{t^o}\) 2Cl2(g) + 2H2O(g)
Xác định Δr\(H^0_{298}\)của phản ứng sau dựa vào giá trị Eb ở Bảng 14.1:
CH4(g) + Cl2(g) \(\underrightarrow{askt}\) CH3Cl(g) + HCl(g)
Hãy cho biết phản ứng trên tỏa nhiệt hay thu nhiệt?
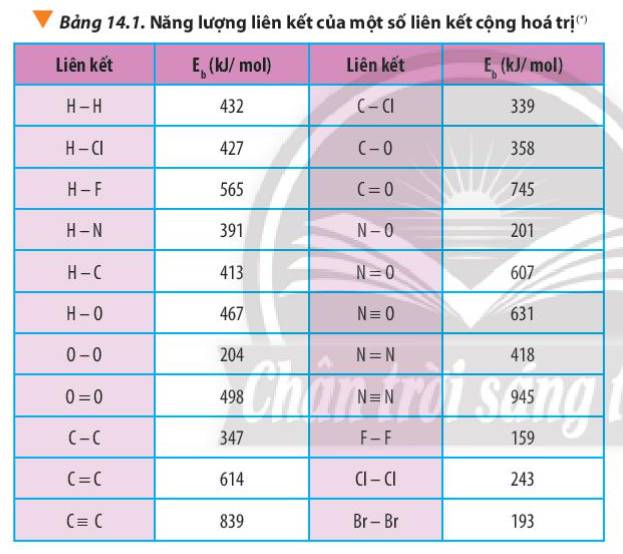
Tính biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết phải viết được công thức cấu tạo của tất cả các chất trong phản ứng để xác định số lượng và loại liên kết. Xác định số lượng mỗi loại liên kết trong các phân tử sau: CH4, CH3Cl, NH3, CO2.
Dựa vào giá trị enthalpy tạo thành ở Bảng 13.1, hãy tính giá trị Δr\(H^0_{298}\)của các phản ứng sau:
CS2(l) + 3O2(g) \(\underrightarrow{t^o}\) CO2(g) + 2SO2(g) (1)
4NH3(g) + 3O2 \(\underrightarrow{t^o}\) 2N2(g) + 6H2O(g) (2)
Tính biến thiên enthalpy của phản ứng phân hủy trinitroglycerin (C3H5O3(NO2)3), theo phương trình sau (biết nhiệt tạo thành của nitroglycerin là -370,15 kJ/mol):4C3H5O3(NO2)3(s) → 6N2(g) + 12CO2(g) + 10H2O(g) + O2(g)Hãy giải thích vì sao trinitroglycerin được ứng dụng làm thành phần thuốc súng không khói.
Đọc tiếp
Tính biến thiên enthalpy của phản ứng phân hủy trinitroglycerin (C3H5O3(NO2)3), theo phương trình sau (biết nhiệt tạo thành của nitroglycerin là -370,15 kJ/mol):
4C3H5O3(NO2)3(s) → 6N2(g) + 12CO2(g) + 10H2O(g) + O2(g)
Hãy giải thích vì sao trinitroglycerin được ứng dụng làm thành phần thuốc súng không khói.